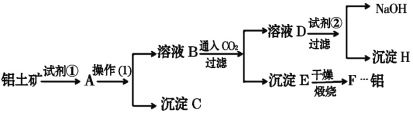
-
下列反应的离子方程式书写正确的是
A. 盐酸与氨水反应:H++OH-=H2O
B. 氯化铝溶液中加入过量氨水:Al3+ + 3NH3•H2O = Al(OH)3↓+ 3NH4+
C. Cl2与H2O的反应:Cl2+ H2O=2H++ Cl-+ClO-
D. 碳酸钙溶液与足量稀盐酸的反应:CO32-+2H+=H2O+CO2↑
难度: 中等查看答案及解析
-
下列物质属于含有共价键的离子化合物的是( )
A.MgCl2 B.H2O C.Na2SO4 D.N2
难度: 简单查看答案及解析
-
下列对化学反应的认识错误的是 ( )
A. 会引起化学键的变化 B. 会产生新的物质
C. 必然引起物质状态的变化 D. 必然伴随着能量的变化
难度: 简单查看答案及解析
-
2020年2月24日,华为MateXs新款5G折叠屏手机开启线上预约销售。下列说法不正确的是( )


A.制造手机芯片的关键材料是硅
B.用铜制作手机线路板利用了铜优良的导电性
C.镁铝合金制成的手机外壳具有轻便抗压的特点
D.手机电池工作时,电池中化学能完全转化为电能
难度: 简单查看答案及解析
-
下列说法中不正确的是( )
A.非金属元素间不可能形成离子键 B.两个非金属原子之间形成的化学键一定是共价键
C.含有离子键的物质不可能是单质 D.单质中不一定含有共价键
难度: 简单查看答案及解析
-
下列说法不正确的是
A.光导纤维的主要成分是硅单质 B.碳酸氢钠用于治疗胃酸过多
C.硫酸铜可用于游泳池消毒 D.过氧化钠可用作漂白剂
难度: 简单查看答案及解析
-
下列用品对应的有效成分及用途错误的是( )
A.
 ;Na2SiO3;防火剂 B.
;Na2SiO3;防火剂 B. ;Na2CO3;发酵粉
;Na2CO3;发酵粉C.
 ;Ca(ClO)2;消毒剂 D.
;Ca(ClO)2;消毒剂 D. ;Al(OH)3;抗酸药
;Al(OH)3;抗酸药难度: 简单查看答案及解析
-
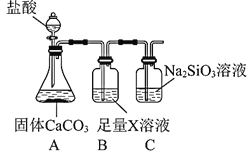
下列金属既能与稀盐酸反应,又能与NaOH溶液反应的是
A.Mg B.Al C.Fe D.Cu
难度: 中等查看答案及解析
-
取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积之比是
A.1:1 B.1:2 C.1:3 D.3:2
难度: 中等查看答案及解析
-
某溶液中有Fe2+、NH4+、Al3+、Fe3+等四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中离子数目维持不变的阳离子是( )
A.Fe2+ B.NH4+ C.Al3+ D.Fe3+
难度: 困难查看答案及解析
-
决定化学反应速率的根本因素是( )
A.温度和压强
B.反应物的浓度
C.参加反应的各物质的性质
D.催化剂的加入
难度: 简单查看答案及解析
-
如图为铜锌原电池示意图。当电池工作时,下列关于该电池的说法正确的是
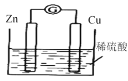
A.铜棒的质量逐渐减小 B.电流由铜电极经过电解质溶液到锌电极
C.SO42-在溶液中向锌极移动 D.H+在锌表面被还原,产生气泡
难度: 简单查看答案及解析
-
不能作为判断硫、氯两种元素非金属性强弱的依据是
A.单质氧化性的强弱 B.最高价氧化物对应的水化物酸性的强弱
C.单质与氢气化合的难易 D.单质沸点的高低
难度: 简单查看答案及解析
-
下列反应速率相同的是
A.使用催化剂和不使用催化剂
B.镁、铝与同浓度盐酸反应
C.大理石块和大理石粉与同浓度盐酸反应
D.0.1 mol/L硫酸和0.2 mol/L盐酸与同浓度的氢氧化钠溶液反应
难度: 简单查看答案及解析
-
1869 年,俄国化学家门捷列夫制作出了第一张元素周期表,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是( )
A.元素周期表含元素最多的族是第ⅢB 族
B.元素周期表有 18 个族
C.第ⅠA 族的元素全部都是金属元素
D.短周期是指第一、二、三、四周期
难度: 简单查看答案及解析
-
中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于
的叙述错误的是
A.原子序数116 B.中子数177
C.核外电子数116 D.在周期表中处于0族
难度: 简单查看答案及解析
-
稀土元素是一类有重要用途的资源。铈(Ce)是一种常见的稀土元素,下列有关说法错误的是( )
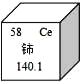
A.铈的原子序数是 58 B.铈原子中的质子数是 58
C.铈属于非金属元素 D.铈的相对原子质量是 140.1
难度: 简单查看答案及解析
-
下列排列顺序不正确的是
A.原子半径:Na>Si>O B.热稳定性:HF>H2O>NH3
C.碱性:CsOH>KOH>NaOH D.失电子能力:Al>Mg>Na
难度: 简单查看答案及解析
-
A、B、C均为短周期元素,它们在周期表中的位置如图所示,已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C符合的一组是( )
A.Be、Na、Al B.B、Mg、Si
C.O、P、Cl D.C、Al、P
难度: 简单查看答案及解析
-
对于下列化学用语,有关说法不正确的是
①SO2②Fe3+③KMnO4④
⑤
A.①表示的是两种元素组成的化合物
B.②中数字的含义:一个铁离子带3个单位的正电荷
C.③中锰元素的化合价为+7价
D.④⑤表示的是同一种元素
难度: 简单查看答案及解析
-
下列关于元素周期表的说法中,正确的是( )
A.元素周期表是按照元素的相对原子质量大小排列而成的
B.元素周期表共有7个周期16个族
C.过渡元素都是金属元素,第ⅠA族都是金属元素
D.最外层电子数相同的元素都在同一族
难度: 简单查看答案及解析
-
研究下表信息可直接得出的结论是
元素
F
Cl
Br
I
氢化物组成
HF
HCl
HBr
HI
氢化物形成难易程度
H2、F2混合,冷暗处剧烈化合并发生爆炸
H2、Cl2混合,光照或点燃时发生爆炸
H2与Br2混合,加热发生化合
H2、I2混合,加热化合,同时又分解
氢化物热稳定性
很稳定
稳定
较稳定
较不稳定
A.元素性质随原子序数的递增而呈周期性变化
B.同周期元素的非金属性随原子序数递增而增强
C.第VII A族元素的金属性随电子层数增加而减弱
D.第VIIA族元素的非金属性随电子层数的增加而减弱
难度: 简单查看答案及解析