-
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是
A.常温常压下X的单质为气态
B.Z的氢化物为离子化合物
C.Y和Z形成的化合物的水溶液呈碱性
D.W与Y具有相同的最高化合价
难度: 中等查看答案及解析
-
化学与生活密切相关。下列叙述错误的是
A.高纯硅可用于制作光感电池
B.氢氧化铝可用于中和过多胃酸
C.绿色化学要求从源头上消除或减少生产活动对环境的污染
D.泡沫灭火器可用于一般的起火,也适用于电器起火
难度: 简单查看答案及解析
-
李兰娟院士团队在汉发布重大抗病毒研究成果,达芦那韦能有效抑制冠状病毒,结构式如图,下列说法正确的是
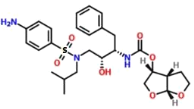
A.分子式C27H36N3O7S
B.属于芳香烃
C.在一定条件下能发生水解,加成,消去反应
D.不能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
下列实验方案能达到实验目的的是
选项
实验目的
实验方案
A
比较Cl与S元素的非金属性强弱
相同条件下,测定相同浓度的NaCl溶液和Na2S溶液的pH,前者小于后者
B
去除乙酸乙酯中少量的乙酸
加入烧碱溶液洗涤、分液
C
蛋白质盐析
向硫酸铵饱和溶液中滴加几滴鸡蛋清溶液,再加入蒸馏水
D
比较Ksp(AgCl)与Ksp(AgI)的大小
向AgNO3溶液中先滴加NaCl溶液,有白色沉淀生成,再滴加NaI溶液,有黄色沉淀生成,说明 Ksp(AgCl)>Ksp(AgI)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知:2H2S(g)+O2(g) = S2(s)+2H2O(l) △H= -632 kJ•mol-1,如图为质子膜H2S 燃料电池的示意图。下列说法正确的是
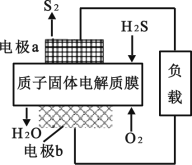
A.标准状况下,每 11.2 LH2S 参与反应,有1 mol H+经固体电解质膜进入正极区
B.电池工作时,电子从电极b 经过质子膜流向电极 a
C.电路中每流过 4 mol 电子,电池内部释放632 kJ 的热能
D.电极b 上发生的电极反应式为:O2+4e-+2H2O = 4OH-
难度: 中等查看答案及解析
-
氮及其化合物的转化过程如图所示。下列分析合理的是
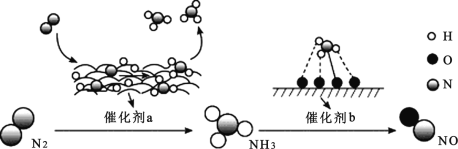
A.催化剂 a 表面发生了共价键的断裂和形成,但分子总数不变
B.在催化剂b 表面形成新的共价键时,存在微粒间的电子转移
C.N2 与H2 反应生成 NH3 的原子利用率不足 100%
D.催化剂 a、b 能提高反应的平衡转化率
难度: 中等查看答案及解析
-
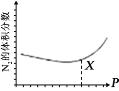
室温下,0.1 mol/L 的某二元酸 H2A 溶液中,可能存在的所有含 A 粒子的物质的量分数随 pH 变化的关系如图所示。下列说法不正确的是
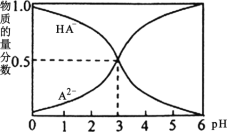
A.H2A 的电离方程式:H2A=H+ + HA-
B.NaHA 溶液显酸性
C.等物质的量浓度的 NaHA 和Na2A 溶液等体积混合,离子浓度大小关系为:c(Na+)>c(A2-)>c(HA-)
D.pH = 5 时,在NaHA 和 Na2A 的混合溶液中: c(HA-) : c(A2-)= 100:1
难度: 困难查看答案及解析
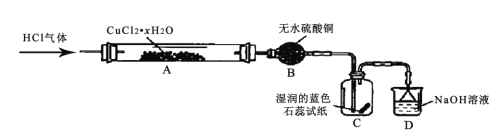
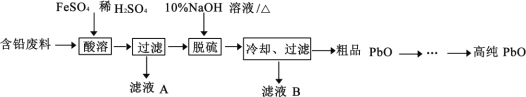
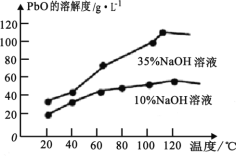
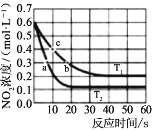
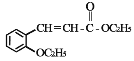 )是合成高分子化合物 M 的单体,H可以通过有机物A(分子式为 C7H8O)和丙酮为原料来进行合成,其合成路线如下:
)是合成高分子化合物 M 的单体,H可以通过有机物A(分子式为 C7H8O)和丙酮为原料来进行合成,其合成路线如下: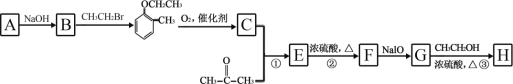
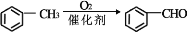
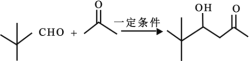
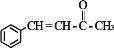 的合成路线_____(无机试剂任选)。
的合成路线_____(无机试剂任选)。