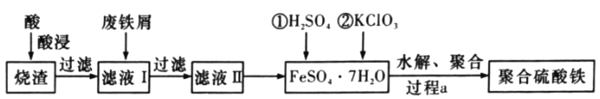
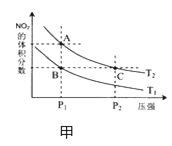
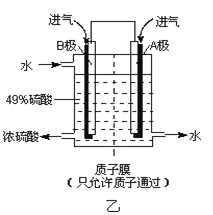
-
下列事实不能用元素周期律解释的是
A. 碱性:NaOH>LiOH B. 热稳定性:Na2CO3>NaHCO3
C. 酸性:HClO4> H2SO4 D. 气态氢化物的稳定性:HBr > HI
难度: 中等查看答案及解析
-
下列事实不能用键能的大小来解释的是 ( )
A.N元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生化学反应
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.F2比O2更容易与H2反应
难度: 中等查看答案及解析
-
化学与生产、生活密切相关。下列叙述正确的是
A.煤的干馏和煤的液化均是物理变化
B.海水淡化的方法有蒸馏法、电渗析法等
C.天然纤维和合成纤维的主要成分都是纤维素
D.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同
难度: 中等查看答案及解析
-
对下列过程的化学用语表述正确的是
A. 用硫酸铜溶液除去乙炔中的硫化氢气体:H2S + Cu2+=== CuS↓ + 2H+
B. 向氯化铝溶液中滴入过量氨水:Al3+ + 4OH- === AlO2- + 2H2O
C. 用电子式表示Na和Cl形成NaCl的过程:
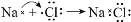
D. 钢铁发生电化学腐蚀的正极反应:Fe-3e- === Fe3+
难度: 中等查看答案及解析
-
设 NA 表示为阿伏加德罗常数,下列叙述中,正确的是( )
A.常温常压下,16 g O2和O3的混合物中共含有NA个氧原子
B.假设1 mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
C.78 g Na2O2 固体中所含阴、阳离子总数为4NA
D.在铜与硫有反应中,1 mol铜原子参加反应失去的电子数为2NA
难度: 中等查看答案及解析
-
下列说法正确的是:
A.SO2 与 CO2 的分子立体构型均为直线形
B.H2O 和 NH3 中的分子的极性和共价键的极性均相同
C.SiO2 的键长大于 CO2 的键长,所以 SiO2 的熔点比 CO2 高
D.分子晶体中只存在分子间作用力,不含有其它化学键
难度: 简单查看答案及解析
-
下列说法不正确的是
A.为除去
溶液中的
,可加入铁粉,再过滤
B.为除去溴苯中的溴,可用
溶液洗涤,再分液
C.为除去乙炔气中少量的
,可使其通过
溶液
D.为除去
中少量的
,可使其通过饱和
溶液
难度: 中等查看答案及解析
-
辣椒素是影响辣椒辣味的活性成分的统称,其中一种分子的结构如下图所示。下列有关该分子的说法不正确的是
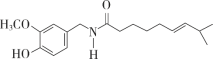
A.分子式为C18H27NO3
B.含有氧原子的官能团有3种
C.能发生加聚反应、水解反应
D.该分子不存在顺反异构
难度: 中等查看答案及解析
-
依据下列实验现象,得出的结论正确的是
操作
实验现象
结论
A
向NaBr溶液中加入氯水,再加入淀粉KI溶液
溶液变蓝
氧化性:Cl2>Br2>I2
B
将铝片放入盐酸中
产生气泡的速率开始时较慢,随后加快,后来又逐渐减慢
H+的浓度是影响反应速率的唯一因素
C
向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜,加热
得到蓝色溶液
蔗糖水解产物没有还原性
D
向漂白粉中滴入稀硫酸,将生成的气体通入品红溶液
品红溶液褪色
气体中含有Cl2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
常温下,下列溶液中各离子浓度关系正确的是
A.浓度为0.1 mol·L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-) +c(H2CO3)
B.pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D.醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-)
难度: 中等查看答案及解析
-
某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
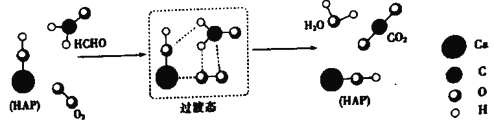
下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2
CO2+H2O
难度: 中等查看答案及解析
-
下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法错误的是( )
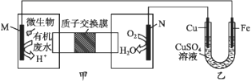
A.甲中H+透过质子交换膜由左向右移动
B.M极电极反应式:H2N(CH2)2NH2+4H2O-16e-
2CO2↑+N2↑+16H+
C.一段时间后,乙中CuSO4溶液浓度基本保持不变
D.当N极消耗0.25 mol O2时,则铁极增重16 g
难度: 中等查看答案及解析
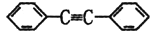 。以互为同系物的芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下: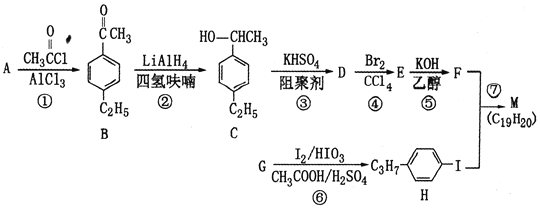
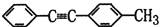 的合成路线。_________________________
的合成路线。_________________________