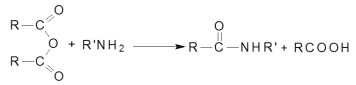
-
化学与生产、生活密切相关,下列说法正确的是( )
A.食品袋中常放有硅胶和铁粉,都能起到干燥的作用
B.地沟油可用来生产肥皂、甘油,达到废物利用的目的
C.用明矾或高铁酸钾(K2FeO4)处理饮用水,既有净水作用,又有杀菌消毒作用
D.天然纤维和合成纤维的主要成分是纤维素
难度: 中等查看答案及解析
-
下列与有机物结构、性质相关的叙述错误的是( )
A.苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
B.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
C.甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同
D.含5个碳原子的有机物,每个分子最多可形成5个C-C单键
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
A.常温下1L0.1mol·L-1NH4NO3溶液中的氮原子数为0.2NA
B.在熔融状态下,lmolNaHSO4完全电离出的阳离子数目为2NA
C.22.4L氯气与足量的金属铁发生氧化还原反应时得到2NA个电子
D.常温常压下,18g重水(D2O)所含的中子数为10NA
难度: 中等查看答案及解析
-
a、b、c、d为原子序数依次增大的短周期主族元素,a的最外层电子数是次外层的2倍,b的最外层只有一个电子,c的最高化合价与最低化合价的代数和为4。下列叙述正确的是( )
A.原子半径:b>d>c>a
B.b与氧元素组成的氧化物一定是碱性氧化物
C.最高价氧化物对应水化物酸性,d的比c的强
D.a、c、d与氢元素形成的化合物中化学键均为极性共价键
难度: 简单查看答案及解析
-
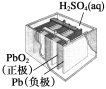
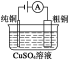
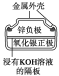
有关下列四个常用电化学装置的叙述中,正确的是( )
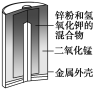
图Ⅰ
碱性锌锰电池
图Ⅱ
铅硫酸蓄电池
图Ⅲ
电解精炼铜
图Ⅳ
银锌纽扣电池
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
难度: 简单查看答案及解析
-
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.10 mol·L-1的NaOH溶液,整个过程中溶液pH变化的曲线如图所示。下列叙述中正确的是

A.点①所示溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)
B.点②所示溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO)
C.点③所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D.点④所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
难度: 简单查看答案及解析
-
由下列实验及现象推出的相应结论正确的是( )
选项
实验
现象
结论
A
向稀硫酸中加入铜片,然后通入氧气加热
先无明显现象,通入氧气加热后溶液变蓝
氧化性:稀硫酸>Cu2+
B
将含有少量CO2的氮气缓缓通过足量的过氧化钠粉末
淡黄色粉末变白
除去CO2,提纯N2
C
在Na2S溶液中滴加新制氯水
产生浅黄色沉淀
证明氯的非金属性比硫的强
D
向某溶液中加入盐酸酸化的BaCl2溶液
有白色沉淀产生
该溶液中一定含有SO42-
A.A B.B C.C D.D
难度: 中等查看答案及解析