-
我国在物质制备领域成绩斐然,下列物质属于有机物的是

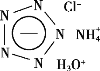
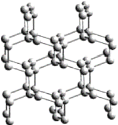
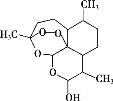
A 砷化铌纳米带
B 全氮阴离子盐
C 聚合氮
D 双氢青蒿素
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.氮气的电子式:
B.氯原子的结构示意图为:
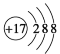
C.Cr的基态原子价电子排布式为:3d54s1 D.聚氯乙烯的链节:CH2=CHCl
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关说法正确的是
A.常温常压下,1.8g甲基(—CD3)中含有的电子数为NA
B.0. lmol环氧乙烷(
)中含有的共价键数为0. 3 NA
C.常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 NA
D.加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,转移电子数小于0.2NA
难度: 中等查看答案及解析
-
下列说法正确的是
A.最外层都只有2个电子的元素原子性质一定相似
B.同一周期元素中,第一电离能随原子序数增加而增大
C.I3AsF6晶体中存在I3+离子,I3+离子的几何构型为V形
D.H2O2是一种含有极性键和非极性键的非极性分子
难度: 简单查看答案及解析
-
化学产品在抗击新型冠状病毒的战役中发挥了重要作用,下列说法不正确的是
A.75%的医用酒精常用于消毒,用95%的酒精消毒效果更好
B.“84”消毒液的主要成分是次氯酸钠
C.用硝酸铵制备医用速冷冰袋是利用了硝酸铵溶于水快速吸热的性质
D.医用防护口罩中熔喷布的生产原料主要是聚丙烯,聚丙烯的单体是丙烯
难度: 简单查看答案及解析
-
2020年1月南开大学周其林团队因《高效手性螺环催化剂的发现》获得国家自然科学一等奖。下面为两种简单碳螺环化合物,相关的说法正确的是

A.上述两种物质中所有碳原子处于同一平面
B.螺[3,3]庚烷的一氯代物有2种
C.螺[3,4]辛烷与3-甲基-1-庚烯互为同分异构体
D.
的名称为螺[5,4]壬烷
难度: 中等查看答案及解析
-
下列指定反应的离子方程式不正确的是
A.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
B.向氨化的饱和NaCl溶液中通入足量CO2气体:Na++ NH3·H2O +CO2=NaHCO3↓+NH4+
C.酸化NaIO3和NaI的混合溶液:I-+IO3-+6H+=I2+3H2O
D.向Mg(OH) 2悬浊液中加入FeCl3溶液:2Fe3++3Mg(OH)2 =2 Fe(OH)3+3Mg2+
难度: 简单查看答案及解析
-
下列装置能达到实验目的的是
A.熔化Na2CO3
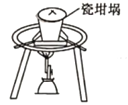 B.验证SO2氧化性
B.验证SO2氧化性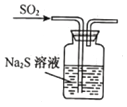
C.实验室制取NH3
 D.保存液溴
D.保存液溴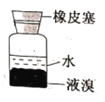
难度: 中等查看答案及解析
-
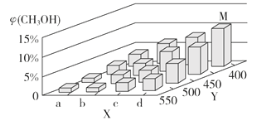
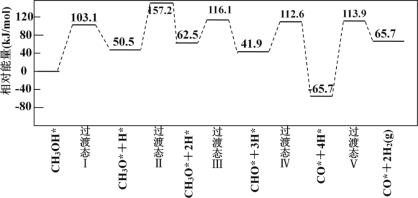
氮及其化合物的转化过程如图所示。下列分析合理的是
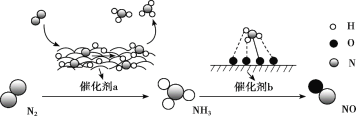
A.N2与H2反应生成NH3的原子利用率为100%
B.催化剂a表面发生了极性共价键的断裂和形成
C.在催化剂b表面形成氮氧键时,不涉及电子转移
D.催化剂a、b能提高反应的平衡转化率
难度: 简单查看答案及解析
-
研究生铁的锈蚀,下列分析不正确的是( )
序号
①
②
③
实验
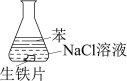
现象
8小时未观察
到明显锈蚀
8小时未观察
到明显锈蚀
1小时观察
到明显锈蚀
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e−+ 2H2O ==4OH−
D. 对比①②③,说明苯能隔绝O2
难度: 中等查看答案及解析
-
下列说法正确的是
A.向NaHCO3溶液中通入CO2至pH=7,则c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.室温下,浓度均为0.1mol/L的CH3COOH、CH3COONa混合溶液的pH=4,则c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10)mol/L
C.加水稀释0.1mol/L醋酸溶液,溶液中
增大
D.室温下,NaHA溶液的pH<7,则一定有c(Na+)=c(HA-)+c(H2A)+c(A2-)
难度: 困难查看答案及解析
-
在3个体积均为4.0 L的恒容密闭容器中,反应 CO2(g)+C(s)
2CO(g) ΔH > 0,分别在一定温度下达到化学平衡状态。下列说法正确的是
容器
温度/K
起始时物质的量/mol
平衡时物质的量/mol
n(CO2)
n(C)
n(CO)
n(CO)
I
977
0.56
1.12
0
0.8
II
977
1.12
1.12
0
x
III
1250
0
0
1.12
y
A.977 K,该反应的化学平衡常数值为4
B.达到平衡时,向容器I中增加C的量,平衡正向移动
C.达到平衡时,容器I中CO2的转化率比容器II中的大
D.达到平衡时,容器III中的CO的转化率大于28.6%
难度: 中等查看答案及解析
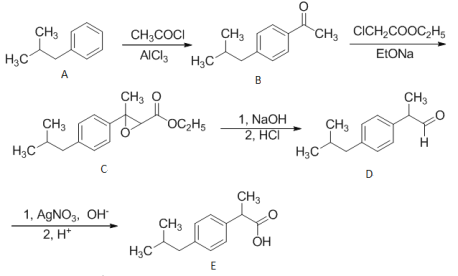
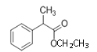 ______________。
______________。