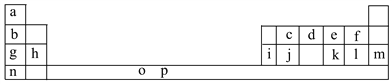
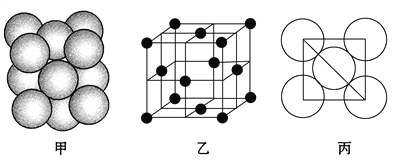
-
闪烁着银白色光泽的金属钛(22Ti)因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域,号称“崛起的第三金属”。已知钛有48Ti、49Ti、50Ti等同位素,下列关于金属钛的叙述中不正确的是
A. 上述钛原子中,中子数不可能为22
B. 钛元素在周期表中处于第四周期
C. 钛的不同同位素在周期表中处于不同的位置
D. 钛元素是d区的过渡元素
难度: 简单查看答案及解析
-
下列说法正确的是
A.分子晶体中一定存在分子间作用力,不一定存在共价键
B.分子中含两个氢原子的酸一定是二元酸
C.含有金属阳离子的晶体一定是离子晶体
D.元素的非金属性越强,其单质的活泼性一定越强
难度: 中等查看答案及解析
-
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是
A.sp,范德华力 B.sp2,范德华力
C.sp2,氢键 D.sp3,氢键
难度: 中等查看答案及解析
-
下列说法中错误的是:
A.SO2、SO3都是极性分子 B.在NH4+和[Cu(NH3)4]2+中都存在配位键 C.元素电负性越大的原子,吸引电子的能力越强 D.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性
难度: 中等查看答案及解析
-
下列有关物质性质、结构的表述均正确,且存在因果关系的是( )
表述Ⅰ
表述Ⅱ
A
在水中,NaCl的溶解度比I2的溶解度大
NaCl晶体中C1—与Na+间的作用力大于碘晶体中分子间的作用力
B
通常条件下,CH4分子比PbH4分子稳定性高
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小
C
在形成化合物时,同一主族元素的化合价相同
同一主族元素原子的最外层电子数相同
D
P4O10、C6H12O6溶于水后均不导电
P4O10、C6H12O6均属于共价化合物
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间以单键结合。下列有关C3N4晶体的说法中正确的是 ( )
A.C3N4晶体是分子晶体
B.C3N4晶体中C—N键的键长比金刚石中的C—C键的键长短
C.C3N4晶体中C、N原子个数之比为4∶3
D.C3N4晶体中微粒间通过离子键结合
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A.原子最外层电子数为2的元素一定处于周期表第ⅡA族
B.主族元素X、Y能形成XY2型化合物,则X与Y的原子序数之差可能为2或5
C.氯化氢的沸点比氟化氢的沸点高
D.同主族元素形成的氧化物的晶体类型均相同
难度: 简单查看答案及解析
-
设阿伏加德罗常数的值为NA,下列结论错误的是 ( )
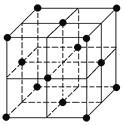
A.完全电解2 mol H2O断裂的σ键键数为4NA
B.标准状况下,11.2 L CO2中含有的π键键数为2NA
C.60 g SiO2晶体中含有的Si—O键键数为4NA
D.128 g金属铜中含有如图所示的晶胞数为0.5NA
难度: 中等查看答案及解析
-
a、b、c、d四种分子均含有14个电子,其有关信息列在下面的表中
a
b
c
d
双原子分子
非极性分子
只含非极性键
双原子分子
极性分子
只含极性键
多原子分子
极性分子
只含极性键
多原子分子
非极性分子
既有非极性键,又有极性键
符合题目给出的信息的选项是( )
①a的化学式N2 ②b的化学式为CO ③c的结构式为H—C≡N ④d的结构简式为HC≡CH ⑤a的符号为
⑥d的化学式为
A.①②③④ B.④⑤⑥
C.②③⑤⑥ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
下列各选项所述的两个量,前者一定大于后者的是 ( )
①Al原子和N原子的未成对电子数 ②Ag+、Cu2+与NH3形成配合物时的配位数 ③H—F的键能与H—I的键能 ④F元素和O元素的电负性 ⑤N和O元素的第一电离能
A.①④⑤ B.②④ C.②④⑤ D.③④⑤
难度: 中等查看答案及解析
-
下列说法中正确的是
A.HF、HCl、H2S、PH3的稳定性依次增强
B.按Mg、Si、N、F的顺序,原子半径由小变大
C.某主族元素的电离能I1~I7数据如表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅤA族
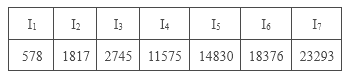
D.在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
难度: 中等查看答案及解析
-
根据元素周期律和物质结构的有关知识,以下有关排序正确的是( )
A.离子半径:Ca2+>Cl->S2-
B.第一电离能:Si>C>N
C.电负性:F>S>Mg
D.热稳定性:SiH4>H2S>H2O
难度: 简单查看答案及解析
-
按下列四种有关性质的叙述,可能属于金属晶体的是
A.由分子间作用力结合而成,熔点很低
B.固体易导电,熔点在1000℃左右
C.由共价键结合成网状晶体,熔点很高
D.固体不导电,但溶于水或熔融后能导电
难度: 简单查看答案及解析
-
下列说法正确的是
A.第二周期元素的第一电离能随原子序数递增依次增大
B.卤族元素中氟的电负性最大
C.CO2、SO2都是直线型的非极性分子
D.CH2=CH2分子中共有四个
键和一个
键
难度: 中等查看答案及解析
-
下列关于价电子排布式为3s23p4的粒子描述正确的是( )
A.它的元素符号为O
B.它的核外电子排布式为1s22s22p63s23p4
C.它可与H2生成液态化合物
D.其电子排布图为
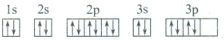
难度: 简单查看答案及解析