-
下列说法正确的是( )
A. 第三能层有s、p共两个能级 B. 3d能级最多容纳5个电子
C. 第三能层最多容纳8个电子 D. 无论哪一能层的s能级最多容纳的电子数均为2个
难度: 中等查看答案及解析
-
下列说法正确的是
A.分子晶体中一定存在分子间作用力,不一定存在共价键
B.分子中含两个氢原子的酸一定是二元酸
C.含有金属阳离子的晶体一定是离子晶体
D.元素的非金属性越强,其单质的活泼性一定越强
难度: 中等查看答案及解析
-
下列化合物中既易发生取代反应,也可发生加成反应,还能使KMn04酸性溶液褪色的是
A. 乙烷 B. 乙醇 C. 丙烯 D. 苯
难度: 简单查看答案及解析
-
已知原子数和价电子数相同的离子或分子结构相似,如SO3、NO都是平面三角形。那么下列分子或离子中与SO42-有相似结构的是( )
A. PCl5 B. CCl4 C. NF3 D. N
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. σ键比π键重叠程度大,形成的共价键强
B. 两个原子之间形成共价键时,最多有一个σ键
C. 气体单质中,一定有σ键,可能有π键
D. N2分子中有一个σ键,2个π键
难度: 中等查看答案及解析
-
某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未能画出),晶体中A、B、C的原子个数比依次为
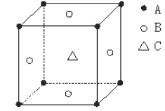
A. 2:2:1
B. 2:3:1
C. 1:3:1
D. 1:3:3
难度: 简单查看答案及解析
-
下列关于元素第一电离能的说法不正确的是
A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大
C.最外层电子排布为ns2np6(当只有K层时为1s2)的原子,第一电离能较大
D.对于同一元素而言,原子的电离能I1<I2<I3<…
难度: 中等查看答案及解析
-
原子数相同、电子总数相同的粒子,互称为等电子体。硼元素可形成三个等电子体阴离子:BO2-、BC2m-和BN2n-,则m、n值为
A.5,3 B.2,4 C.3,1 D.1,2
难度: 简单查看答案及解析
-
萤石(CaF2)是一种难溶于水的固体。下列实验事实能说明CaF2一定是离子晶体的是( )
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4。下列说法正确的是( )
A.W、Y、Z的电负性大小顺序一定是Z>Y>W
B.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z
C.Y、Z形成的分子的空间构型可能是正四面体
D.WY2分子中σ键与π键的数目之比是2:1,属于分子晶体
难度: 中等查看答案及解析
-
通常情况下,原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半充满”、“全充满”的时候一般更加稳定,称为洪特规则的特例,下列事实能作为这个规则证据的是
①元素氦(He)的第一电离能远大于元素氢(H)的第一电离能
②26Fe2+容易失电子转变为26Fe3+,表现出较强的还原性
③基态铜(Cu)原子的电子排布式为[Ar]3d104s1而不是[Ar]3d94s2
④某种激发态碳(C)原子电子排布式为1s22s12p3而不是1s22s22p2
A.①② B.②③ C.③④ D.全部
难度: 中等查看答案及解析
-
下列微粒半径大小的比较正确的是( )
A.Na+<Mg2+<Al3+<O2- B.S2-<Cl-<Na+<Al3+
C.Na<Mg<Al<S D.Cs>Rb>K>Na
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.离子晶体不一定都含有金属元素
B.离子晶体中除含离子键外,还可能含有其他化学键
C.金属元素与非金属元素构成的晶体不一定是离子晶体
D.熔化后能导电的晶体一定是离子晶体
难度: 中等查看答案及解析
-
下列有机物的酸性由强到弱排列正确的是
A.碳酸、甲酸、乙酸、苯酚 B.乙酸、甲酸、碳酸、苯酚
C.甲酸、碳酸、乙酸、苯酚 D.甲酸、乙酸、碳酸、苯酚
难度: 简单查看答案及解析
-
化学与科技、社会、生活有着密切的联系,下列说法不正确的是
A.橡胶、塑料和光导纤维都是有机高分子化合物
B.废电池要集中处理,防止其中的重金属盐对土壤和水源造成污染
C.从海水提取金属镁的过程中涉及氧化还原反应
D.利用太阳能、风能和氢能替代化石能源能改善空气质量
难度: 中等查看答案及解析
-
高分子材料的合成与应用使我们的生活变得更加丰富多彩,下列关于高分子材料的说法正确的是( )
A.聚乙烯结构中存在碳碳双键
B.聚乙烯可由乙烯通过取代反应制得
C.聚乙烯与聚氯乙烯都是合成高分子材料
D.聚氯乙烯可由氯气与乙烯通过加聚反应制得
难度: 简单查看答案及解析
-
可用于鉴别以下三种化合物的一组试剂是( )

乙酰水杨酸 丁香酚 肉桂酸
① 银氨溶液 ② 溴的四氯化碳溶液 ③ 氯化铁溶液 ④ 氢氧化钠溶液
A.②与③ B.③与④ C.①与④ D.①与②
难度: 中等查看答案及解析
-
除去乙烷中乙烯的办法是( )
A.点燃 B.通过溴水 C.通过酸性高锰酸钾溶液 D.通过石灰水
难度: 简单查看答案及解析
-
目前已知化合物中数量、品种最多的是第IVA碳的化合物(有机化合物),下列关于其原因的叙述中不正确的是
A.碳原子既可以跟自身,又可以跟其他原子(如氢原子)形成4个共价键
B.碳原子性质活泼,可以跟多数元素原子形成共价键
C.碳原子之间既可以形成稳定的单键,又可以形成稳定的双键和三键
D.多个碳原子可以形成长度不同的链、支链及环,且链、环之间又可以相互结合
难度: 简单查看答案及解析
-
2014年南京青奥会吉祥物为“砳砳”,一种“砳砳”的外用材料是纯羊毛线,内充物为涤纶(结构简式为
 ),下列有关说法不正确的是( )
),下列有关说法不正确的是( )A.羊毛的主要成分属于蛋白质
B.涤纶属于天然高分子化合物
C.合成涤纶的单体之一可以是HOCH2CH2OH
D.可用灼烧的方法区别羊毛和涤纶
难度: 简单查看答案及解析
-
下列实验操作,不能用来分离提纯物质的是( )
A.萃取 B.蒸馏 C.过滤 D.称量
难度: 简单查看答案及解析
-
一有机物A可发生如下变化,已知C为羧酸,而C、E都不能发生银镜反应,则A可能的结构有( )

A.2种 B.3种 C.4种 D.5种
难度: 中等查看答案及解析
-
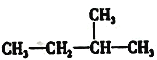
下列式子是某学生书写C5H12的同分异构体的结构简式
①CH3CH2CH2CH2CH3 ②
 ③
③
④
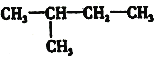 ⑤
⑤
这些结构中出现重复的是
A.①和② B.④和⑤ C.②③④ D.均不重复
难度: 简单查看答案及解析
 。著名的蓝瓶子实验操作步骤如下:
。著名的蓝瓶子实验操作步骤如下: