-
下列有关生活中常见物质的说法正确的是
A.涤纶衬衣、橄榄油、牛皮鞋均是由有机高分子化合物构成的
B.豆浆煮沸后,蛋白质变成了氨基酸
C.高锰酸钾溶液、酒精、双氧水能杀菌消毒,都利用了其强氧化性
D.蔗糖、淀粉、油脂均能水解产生非电解质
难度: 简单查看答案及解析
-
化合物
(x)、
(y)、
(z)的分子式均为C5H6。下列说法正确的是
A.x、y、z均能使酸性高锰酸钾溶液褪色
B.z的同分异构体只有x和y两种
C.z的一氯代物只有一种,二氯代物只有两种(不考虑立体异构)
D.x分子中所有原子共平面
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温下,l mol C6H12中含碳碳键的数目一定小于6NA
B.18g果糖分子中含羟基数目为0.6NA
C.4.0g由H218O与D216O组成的混合物中所含中子数为2NA
D.50g质量分数为46%的乙醇溶液与足量的钠反应,放出H2的分子数目为0.25NA
难度: 简单查看答案及解析
-
X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙,甲是常见温室效应气体。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物,其转化关系如图所示。下列判断不正确的是
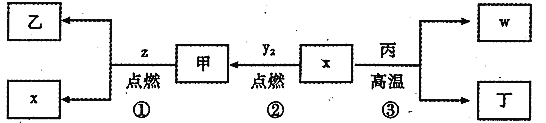
A.反应①②③都属于氧化还原反应 B.X、Y、Z、W四种元素中,W的原子半径最大
C.在信息工业中,丙常作光导纤维材料 D.一定条件下,x与甲反应生成丁
难度: 简单查看答案及解析
-
用下列装置进行实验能达到相应实验目的的是
A.
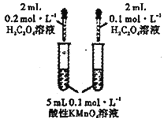 装置探究浓度对化学反应速率的影响
装置探究浓度对化学反应速率的影响B.
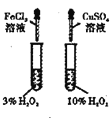 装置探究催化剂对H2O2分解速率的影响
装置探究催化剂对H2O2分解速率的影响C.
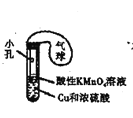 装置制取SO2气体并验证其还原性(可加热)
装置制取SO2气体并验证其还原性(可加热)D.
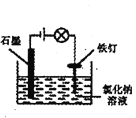 装置防止铁钉生锈
装置防止铁钉生锈难度: 简单查看答案及解析
-
近年来,我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀。下列说法正确的是

A.阴极的电极反应式为4OH--4e-=O2↑+2H2O B.阳极的电极反应式为Zn-2e-=Zn2+
C.通电时,该装置为牺牲阳极的阴极保护法 D.断电时,锌环失去保护作用
难度: 简单查看答案及解析
-
已知298K时,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0× 10-18,其沉淀溶解平衡曲线如图所示(图中R表示Ni或Fe),下列说法正确的是(已知:
≈2.4,
≈3.2) ( )
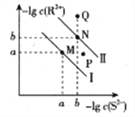
A.M点对应的溶液中,c(S2-)≈3.2×10-11 mol·L-1
B.与P点相对应的NiS的分散系是均一稳定的
C.向Q点对应的溶液中加水,可转化成N点对应的溶液
D.FeS+Ni2+
NiS+Fe2+的平衡常数K=6000
难度: 中等查看答案及解析

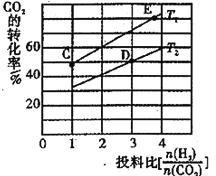
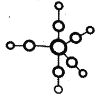
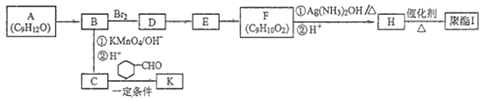
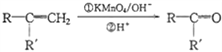 +CO2
+CO2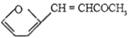 )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(