-
已知:金属X在常温下能与空气中的氧气反应,而金属Y和Z不能;将Y 、Z分别投入稀盐酸中,Y溶解并产生气泡,Z无变化。下列说法正确的是
A. X氧化物的化学式只能表示为XO B. Y能将X从它的盐溶液中置换出来
C. Z在自然界中只能以单质形式存在 D. 三种金属的活动性顺序:X>Y>Z
难度: 中等查看答案及解析
-
硅晶体广泛应用于电子工业的各个领域,工业上常用焦炭在高温下还原二氧化硅固体初步制得,主要反应为SiO2+2C高温Si+2CO2↑。下列说法不正确的是( )
A. 该反应为置换反应
B. SiO2中硅元素的化合价为+4
C. 反应后固体质量减小
D. 地壳中硅元素含量小于铁元素
难度: 中等查看答案及解析
-
以下四组物质中,能在pH=11的溶液中大量共存且溶液呈无色的一组是( )
A. HCl NaCl ZnSO4 B. MgCl2 NaNO3 KOH
C. Na2CO3 BaCl2 CuSO4 D. KCl NaCl NaNO3
难度: 困难查看答案及解析
-
“绿水青山就是金山银山”。下列做法符合这一理念的是( )
A. 直接排放生活污水 B. 露天焚烧农田秸秆
C. 深埋处理废旧电池 D. 开发利用清洁能源
难度: 简单查看答案及解析
-
学习化学需要使用化学符号。下列叙述正确的是( )
A.NH3表示3个氨气分子
B.氯化钾溶液中含有K+和Cl﹣
C.2N表示2个氮原子或2个氮元素
D.铝片表面氧化物的化学式为AlO
难度: 中等查看答案及解析
-
下列原子结构示意图中,表示相对稳定结构的是
A.
B.
C.
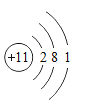 D.
D.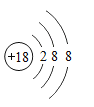
难度: 简单查看答案及解析
-
天然气燃烧反应的微观示意图如图。由图可得到的结论是( )
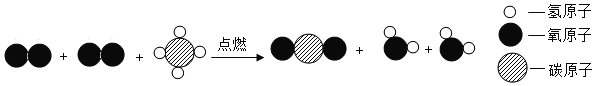
A. 反应前后共有6种物质
B. 反应物中没有单质
C. 反应前后分子数目没有增减
D. 反应过程中共涉及三种氧化物
难度: 中等查看答案及解析
-
下列对实验现象的描述符合事实的是( )
A. 硫在空气中燃烧,发出蓝紫色火焰
B. NH4NO3固体溶于水,溶液的温度升高
C. 黄铜片与铜片相互刻画,铜片上有划痕
D. 打开盛有浓盐酸的试剂瓶,有大量白烟产生
难度: 中等查看答案及解析
-
甲、乙、丙三种固体物质的溶解度曲线如图所示,从中获取的信息正确的是( )
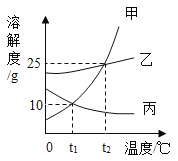
A. 蒸发溶剂可使丙的饱和溶液变为不饱和溶液
B. t2℃时,100g甲的饱和溶液降温至t1℃,析出甲的质量为15g
C. t1℃时,甲、乙、丙三种溶液所含溶质的质量可能相同
D. t2℃时,甲、乙、丙的饱和溶液降温至t1℃,所得溶液的溶质质量分数大小顺序为乙>甲=丙
难度: 困难查看答案及解析
-
下列排序正确的是( )
A.空气中物质的含量
B.溶液的pH
C.氮元素的化合价
D.硫元素的质量分数
难度: 中等查看答案及解析
-
下列各组实验方案中,不能达到实验目的的是
选项
实验目的
实验方案
A
稀释浓硫酸
将浓硫酸缓慢注入水中,并不断搅拌
B
除去CO2气体中的HCl
将气体通过盛有足量NaOH溶液的洗气瓶
C
鉴别化肥KNO3和NH4NO3
取样,加Ca(OH)2固体混合研磨,闻气味
D
除去FeCl2溶液中的CuCl2
加入过量的Fe粉,充分反应后过滤
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
甲、乙、丙、X、Y、Z六种物质间只通过一步反应就能实现右图中箭头所示的转化。不符合上述要求的一组物质是
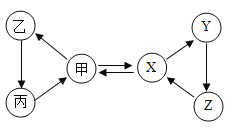
选项
甲
X
A
O2
H2O
B
CO2
CaCO3
C
Fe
Fe3O4
D
NaOH
NaNO3
A.A B.B C.C D.D
难度: 中等查看答案及解析