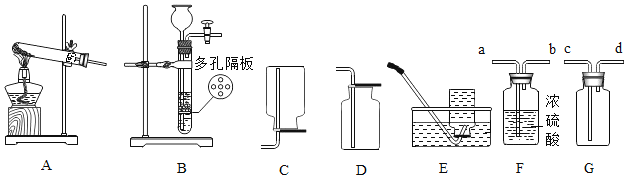
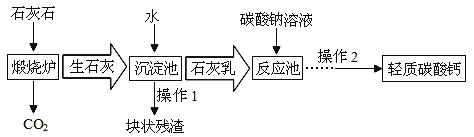
-
“绿水青山就是金山银山”已成为国家意志和全民共识。下列做法不符合“建设美丽中国,保护生态环境”的是( )
A. 为维持好碳、氧循环,大力植树造林,减少化石燃料燃烧
B. 为提高农作物产量并减少对环境的污染,合理使用农药和化肥
C. 为解决“白色污染”问题,应将废旧塑料袋焚烧处理
D. 为保护赖以生存的水资源,生活污水、工业废水要处理后排放
难度: 中等查看答案及解析
-
除去下列物质中的少量杂质,所选用的试剂及操作方法都正确是
选项
物质
杂质
试剂
操作方法
A
氯化钾
氯酸钾
二氧化锰
混合、充分加热
B
氯化钠溶液
氯化钙
适量纯碱溶液
溶解、过滤、蒸发、结晶
C
水
植物油
明矾
吸附
D
二氧化碳
水蒸气
浓硫酸
通过装足量浓硫酸的洗气瓶
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
推理是化学学习中常用的思维方法,下列推理正确的是( )
A.中和反应生成盐和水,生成盐和水的反应一定是中和反应
B.酸雨呈酸性,呈酸性的雨水一定是酸雨
C.碳酸盐能与稀盐酸反应放出气体,则能与稀盐酸反应放出气体的物质一定是碳酸盐
D.碱性溶液能使酚酞溶液变红,能使酚酞溶液变红的溶液一定呈碱性
难度: 简单查看答案及解析
-
化学在生活、生产中应用广泛,下列过程不属于化学变化的是( )
A.
 光合作用
光合作用B.
 冶炼金属
冶炼金属C.
 葡萄酿酒
葡萄酿酒D.
 活性炭除臭
活性炭除臭难度: 简单查看答案及解析
-
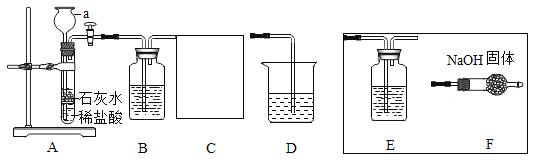
下列实验操作中,错误的是( )
A.
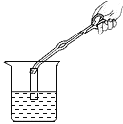 测溶液的pH B.
测溶液的pH B.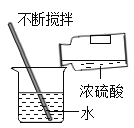 稀释浓硫酸
稀释浓硫酸C.
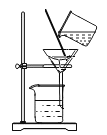 净化黄泥水 D.
净化黄泥水 D.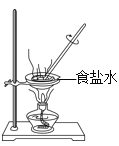 蒸发食盐水
蒸发食盐水难度: 简单查看答案及解析
-
近日,李兰娟院士公布治疗新型冠状病毒感染肺炎的最新研究成果,建议将达芦那韦加入到新型肺炎的治疗中。达芦那韦是蛋白酶抑制剂,化学式为C27H37N3O7S,对于新冠肺炎有一定的抑制作用,效果较高。下列有关达芦那韦的说法正确的是( )
A.达芦那韦是由C、H、N、O、S五种元素组成的无机化合物
B.达芦那韦是由27个碳原子、37个氢原子、3个氮原子、7个氧原子和1个硫原子构成的
C.达芦那韦的相对分子质量为547g
D.达芦那韦中碳元素的质量分数最大
难度: 简单查看答案及解析
-
甲和乙在一定条件下反应生成丙和丁。结合微观示意图分析,下列结论正确的是
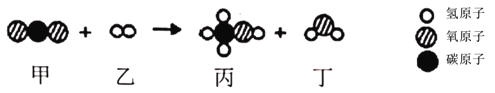
A.该反应中反应物的质量之比与生成物的质量之比相等
B.该反应中共有两种有机物
C.生成的丙和丁的分子个数比为1:1
D.该反应为置换反应
难度: 简单查看答案及解析
-
如图是硒元素在元素周期表中的信息及原子结构示意图,下列说法错误的是( )
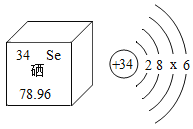
A.硒元素是第四周期的非金属元素
B.硒是人体必需的微量元素有防癌抗癌的作用
C.硒元素的相对原子质量为78.96
D.硒原子的原子序数为34,图中的x为8
难度: 简单查看答案及解析
-
哈工大科技成果与冰城制造助力“长五B”首飞告捷。下列有关说法错误的是

A.研发兼具金属特性与高弹性的金属橡胶构件,破解高真空、大温差下阻尼减震难题
B.机器人焊接技术使用了多种焊剂,其中的焊锡的主要成分是铅、锡
C.研制陶瓷轴承为液氢涡轮发动机提供技术支撑,陶瓷属于合成材料
D.中铝东轻公司为“长五B”火箭“轻如蝉翼”却“坚不可摧”的战甲生产的铝合金具有强度高、硬度好等性能
难度: 简单查看答案及解析
-
将知识归纳是学习化学的重要方法,下列归纳正确的是
A.
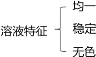 溶液的特征 B.
溶液的特征 B. 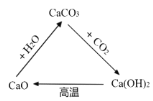 含钙物质的转化
含钙物质的转化C.
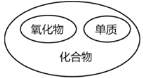 物质的分类 D.
物质的分类 D. 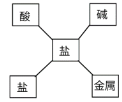 盐的化学性质
盐的化学性质难度: 中等查看答案及解析
-
下列实验设计能达到实验目的的是:
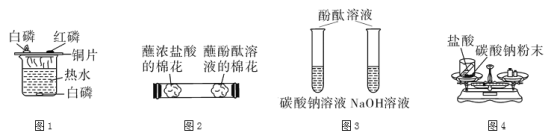
A.图1探究可燃物燃烧的条件 B.图2探究分子是运动的
C.图3鉴别两种物质 D.图4探究质量守恒定律
难度: 中等查看答案及解析
-
图表法是一种常用的数据处理方法,根据所给图表(氢氧化钠、碳酸钠分别在水、酒精中的溶解度如表所示),下列说法正确的是( )
氢氧化钠
碳酸钠
20℃
40℃
20℃
40℃
水
109g
129g
21.8g
49g
酒精
17.3g
40g
不溶
不溶
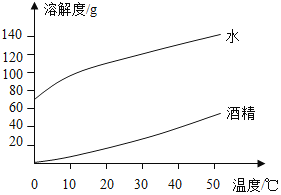
A.上述图象表示碳酸钠的溶解度曲线
B.20℃时,氢氧化钠的溶解度大于碳酸钠
C.40℃时,若将 50g NaOH 分别投入到 100g 水和 100g 酒精中,都能形成饱和溶液
D.40℃时,将适量 CO2 通入饱和的 NaOH 酒精溶液中,观察不到明显的现象
难度: 困难查看答案及解析