-
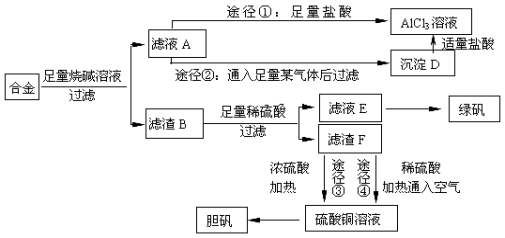
(16分)把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量的水中,有1.16g白色沉淀析出,向所得的浊液里,逐渐加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:
(1)写出mn段反应的离子方程式_______________________
(2)混合物中NaOH的物质的量是_______________,AlCl3的物质的量是________________,MgCl2的物质的量是______________。
(3)P点所表示的加入盐酸的体积是_______________mL。
难度: 中等查看答案及解析
-
【化学——选修2:化学与技术】(15分)
普通纸张的主要成分是纤维素。在早期的纸张生产中,常采用纸张表面涂敷明矾的工艺,以填补其表面的微孔,防止墨迹扩散。请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存,经分析检验,发现酸性腐蚀主要与造纸中涂明矾的工艺有关,其中的化学原理是 ;为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等。这样操作产生的问题是 ;
②喷洒 Zn(C2H5 )2 • Zn(C2H5 )2可以与水反应生成氧化锌和乙烷。用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理 、 。
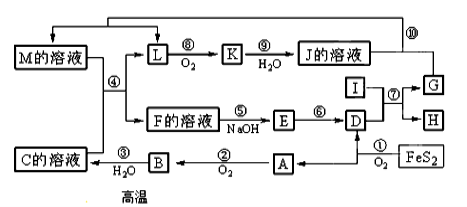
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾。钛白粉的一工业制法是以钛铁矿(主要成分为FeTiO3)为原料按下列过程进行的,请完成下列化学方程式:
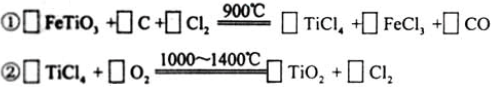
难度: 困难查看答案及解析
-
【化学——选修3:物质结构与性质】(15分)
氮化硼(BN)是一种重要的功能陶瓷材料,以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
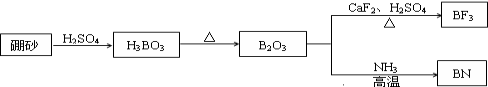
请回答下列问题:
(1)由B3O3制备BF3、BN的化学方程式依次是_____________、_____________;
(2)基态B原子的电子排布式为____________;B和N相比,电负性较大的是___________,BN中B元素的化合价为______________;
(3)在BF3分子中,F—B—F的键角是____________,B原子的杂化轨道类型为____________,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为_____________;
(4)在与石墨结构相似的六方氮化硼晶体中,层层内B原子与N原子之间的化学键为___________,层间作用力为___________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有_________________个氮原子、______________个硼原子,立方氮化硼的密度是_________________g.cm-3(只要求列算式,不必计算出数值。阿伏伽德罗常数为NA)。
难度: 困难查看答案及解析
-
【化学—选修5:有机化学基础】(14分)
I、某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入适当过量稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入400 mL 0.5 mol/L的Na2SO3溶液,蓝色恰好完全退去。
(1)写出实验①中反应的离子方程式:_____________________。
(2)实验②的化学反应中转移的电子数为_______________。
(3)以上实验说明:在上述条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是___________________。
II、H2O2既有氧化性又有还原性,在+2价的锰盐或+3价的铬盐等催化下,会发生自身氧化还原反应,生成H2O和O2。完成并配平以下离子方程式:
①反应中的氧化剂是______________;被氧化的元素是____________。
②若化学方程式中KMnO4、H2O2的系数分别是2和7,也能配平这个方程式,但此时H2O2除了跟KMnO4反应外,还发生的反应是(用化学方程式表示)___________________。
难度: 困难查看答案及解析