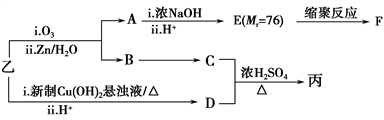
-
将锌、铁、铜粉末按一定比例混合投入到一定量的硝酸中,微热、充分反应后,过滤,弃掉滤渣,滤液中金属离子情况不可能是
A. 只含Cu2+、Fe3+、Zn2+ B. 只含Zn2+
C. 只含Zn2+、Fe2+ D. 只含Cu2+、Fe2+、Zn2+
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. 容量瓶、分液漏斗、酸碱滴定管、冷凝管等仪器在使用前均需要检查是否漏液
B. 蒸发、蒸馏、配制标准物质的量浓度溶液均需要用到玻璃棒
C. 液溴保存:用带玻璃塞的细口棕色试剂瓶,液溴上加一层水,放在阴凉处
D. 烧瓶、量筒、容量瓶、滴定管洗净后均可放在烘箱中烘干
难度: 简单查看答案及解析
-
前者为物理变化,后者为化学变化的是
A. 焰色反应、颜色反应 B. 电解、电离
C. 裂化、裂解 D. 干馏、蒸馏
难度: 简单查看答案及解析
-
分类是科学研究的重要方法,讨论辨析以下说法:①漂白粉、铝热剂、粗盐都是混合物;②酸性氧化物都是非金属氧化物;③胆矾和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤油脂、淀粉、蛋白质既是营养物质又是高分子化合物;⑥乙醇、四氯化碳、氯气、葡萄糖都是非电解质;⑦豆浆和雾都是胶体。上述说法正确的是
A. ①②③④ B. ①③④⑦ C. ①②⑤⑥ D. ③⑤⑥⑦
难度: 简单查看答案及解析
-
下列实验合理的是( )
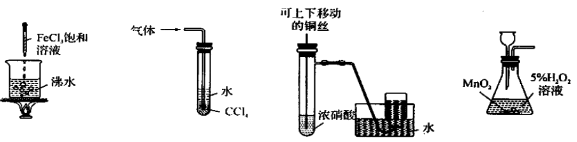
A.得到红褐色沉淀
B.吸收氨气,并防止倒吸
C.制备并收集少量NO2气体
D.实验室制O2
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的数值,下列叙述正确的是
①标况下2.24L己烷中,含1.4NA个C-H键
②常温常压下,16gO2和O3混合气体中,电子数为8NA
③过氧化钠与水反应,产生3.2g氧气,则电子转移数目为0.2NA
④0.1mol/LKAl(SO4)2溶液中含Al3+数目小于0.1NA
⑤将0.1molFeCl3配成氢氧化铁胶体,胶体粒子数目最多可达到0.1NA
⑥将2.8gN2与足量氢气充分反应,得到氨气分子数目少于0.2NA
A. ①②④⑥ B. ③④⑤⑥
C. ②③⑥ D. ②③④
难度: 中等查看答案及解析
-
下列各组物质分离提纯中,试剂选择和实验方法均正确的是
序号
混合物(括号内为杂质)
除杂试剂
除杂方法
A
CH3COOC2H5(CH3COOH)
NaOH溶液
分液
B
CO2(CO)
O2
点燃
C
NaCl溶液(少量KCl)
蒸发结晶,趁热过滤
D
从碘酒中提取碘
四氯化碳
萃取、分液
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是
A. 质量相等时具有相同的质子数
B. 体积相等时具有相同的电子数
C. 体积相等时密度相等
D. 原子相等时具有相同的中子数
难度: 中等查看答案及解析
-
已知质量分数为98%的浓硫酸,密度为1.84g/mL,下列有关说法不正确的是
A. 该硫酸物质的量浓度为18.4mol/L
B. 取10mL该溶液,加等质量的水混合后,所得硫酸物质的量浓度小于9.2mol/L
C. 取10g该溶液,加入等体积水混合后,所得硫酸质量百分比浓度大于49%
D. 将该硫酸盛放在U型干燥管中,可用来干燥H2、SO2、H2S等气体
难度: 中等查看答案及解析
-
下列有关氢氧化铁胶体说法正确的是
A. 将外加直流电源通过该胶体,阴极处颜色变深,则说明该胶体带正电荷
B. 鉴别FeCl3溶液和Fe(OH)3胶体,可用丁达尔效应或观察颜色两种方法
C. 采用过滤,可将Fe(OH)3胶体中的FeCl3杂质除去
D. 向Fe(OH)3胶体中加入大量盐酸溶液,则可引起胶体聚沉
难度: 简单查看答案及解析
-
下列离子方程式或电离方程式书写正确的是
A. NaHCO3电离:NaHCO3
Na+ + H+ + CO32-
B. FeBr2与Cl2物质的量之比1:1反应:2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2Br2 + 6Cl-
C. 向稀NaHSO4溶液中滴加Ba(OH)2溶液至恰好沉淀达到最大量:HSO4- + Ba2+ + OH- = BaSO4↓ + H2O
D. 向漂白粉溶液中通入过量SO2气体:2H2O + Ca2+ + 2ClO- + 2SO2 = CaSO4↓+ 2Cl- + 4H+ + SO42-
难度: 中等查看答案及解析
-
下列有关离子检验的方法及结论均正确的是
A. 取待测液于试管中,依次加入盐酸、Ba(NO3)2溶液,产生白色沉淀,则原溶液含有SO42-
B. 取待测液于试管中,通入氯气,滴加KSCN溶液后呈血红色,则原溶液含有Fe2+
C. 取固体于试管中加热,用湿润的红色石蕊试纸靠近试管口变蓝,则可证明固体为铵盐
D. 取待测液于试管中,加入硝酸酸化硝酸银,产生白色沉淀,则原溶液含有Cl-
难度: 中等查看答案及解析
-
下列各组离子在给定条件下能大量共存的是
A. 无色溶液:Fe2+、Na+、NO3-、ClO-
B. 通入足量CO2后仍能大量共存的溶液:Ca2+、NH4+、NO3—、Cl—
C. 加入铝片产生氢气的溶液:Al3+、Na+、NO3-、Br-
D. c(H+)/c(OH-)=10-12的溶液:Fe3+、NH4+、HCO3-、SO42-
难度: 中等查看答案及解析
-
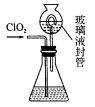
已知反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,下列对该反应叙述不正确的是
A. KCl既不是氧化产物,又不是还原产物
B. KClO3→Cl2的过程发生了还原反应
C. 氧化剂与还原剂物质的量之比为1:5
D. 每转移1mol电子,则产生13.44L气体
难度: 简单查看答案及解析
-
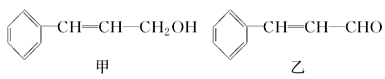
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如图所示,下列说法正确的是

A. 该有机物分子式为:C7H10O3
B. 该有机物所有质子可能在同—平面
C. 该有机物能发生取代、加成、氧化、还原反应
D. 该有机物的一种含苯环的同分异构体能发生银镜反应
难度: 中等查看答案及解析
-
分子式为C3H7ClO,加入金属钠能产生气体,符合条件的同分异构体数目为(不考虑空间异构)( )
A. 5 种 B. 4 种
C. 3 种 D. 2 种
难度: 中等查看答案及解析