-
2019年9月25日,全世界几大空之一―—北京大兴国际机场,正式投运。下列相关说法不正确的是( )
A.机杨航站楼所用钢铁属于合金材料
B.航站楼使用的玻璃是无机非金属材料
C.航站楼采用的隔震支座由橡胶和钢板相互叠加粘结而成,属于新型无机材料
D.机场高速应用自融冰雪路面技术,减少了常规融雪剂使用对环境和桥梁结构造成的破坏
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.金属汞一旦活落在实验室地面或桌面时,必须尽可能收集,并深理处理
B.氨氮废水(含NH4+及NH3 ) 可用化学氧化法或电化学氧化法处理
C.做蒸馏实验时,在蒸馏烧瓶中应加人沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
D.用pH计、电导率仅(一种测量溶渡导电能力的仪器)均可检测乙酸乙酯的水解程度
难度: 中等查看答案及解析
-
2019 年是元素周期表诞生的第 150 周年,联合国大会宣布 2019 年是“国际化学元素周期表年”。W、X、Y 和 Z 为原子序数依次增大的四种短周期主族元素。W 的一种核素可用于文物年代的测定, X 与 W 同周期相邻,四种元素中只有 Y 为金属元素,Z 的单质为黄绿色气体。下列叙述正确的是
A.W 的氢化物中常温下均呈气态
B.Z 的氧化物对应的水化物均为强酸
C.四种元素中,Z 原子半径最大
D.Y 与 Z 形成的化合物可能存在离子键,也可能存在共价键
难度: 中等查看答案及解析
-
PET(
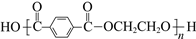 ,M链节= 192 g·mol−1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L−1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
,M链节= 192 g·mol−1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L−1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是A.PET塑料是一种可降解高分子材料
B.滴定终点时,溶液变为浅红色
C.合成PET的一种单体是乙醇的同系物
D.PET的平均聚合度
(忽略端基的摩尔质量)
难度: 简单查看答案及解析
-
下列有关描述中,合理的是
A.用新制氢氧化铜悬浊液能够区别葡萄糖溶液和乙醛溶液
B.洗涤葡萄糖还原银氨溶液在试管内壁产生的银:先用氨水溶洗、再用水清洗
C.裂化汽油和四氯化碳都难溶于水,都可用于从溴水中萃取溴
D.为将氨基酸混合物分离开,可以通过调节混合溶液pH,从而析出晶体,进行分离。
难度: 中等查看答案及解析
-
工业上电解MnSO4溶液制备Mn和MnO2,工作原理如图所示,下列说法不正确的是
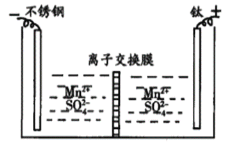
A.阳极区得到H2SO4
B.阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+
C.离子交换膜为阳离子交换膜
D.当电路中有2mole-转移时,生成55gMn
难度: 中等查看答案及解析
-
电解质的电导率越大,导电能力越强。用0.100mol·L-1的KOH溶液分别滴定体积均为20.00mL、浓度均为0.100mol•L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
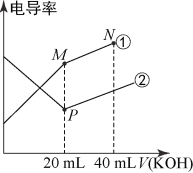
A. 曲线②代表滴定CH3COOH溶液的曲线
B. 在相同温度下,P点水电离程度大于M点
C. M点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol·L-1
D. N点溶液中:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
难度: 中等查看答案及解析


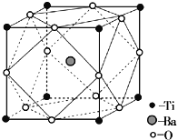
 )是治疗心脏病的一种重要药物,可由简单有机物 A、B 和萘(
)是治疗心脏病的一种重要药物,可由简单有机物 A、B 和萘( 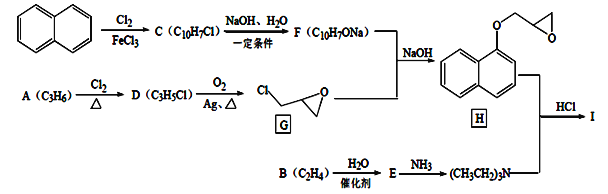
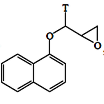 则反应中G(
则反应中G(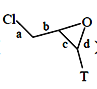 )断裂的化学键为 _______(填编号)
)断裂的化学键为 _______(填编号)