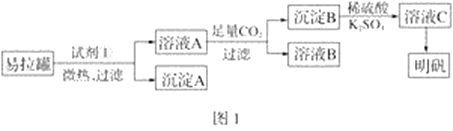
-
把5%的碳酸钠溶液蒸发掉64.3 g水后,溶液变为31 mL,浓度变为14%,没有晶体析出,则浓缩后碳酸钠溶液的物质的量浓度为( )
A. 8.52 mol·L-1 B. 4.26 mol·L-1
C. 1.52 mol·L-1 D. 3.04 mol·L-1
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 溶液是电中性的,胶体是带电的
B. 胶体和溶液的本质区别是能否产生丁达尔效应
C. 胶体是一种介稳性的分散系,而溶液是一种稳定的分散系
D. 向饱和FeCl3溶液中缓慢滴加稀NaOH溶液,可制得Fe(OH)3胶体
难度: 中等查看答案及解析
-
过滤和蒸发结晶实验中,都可能用到的仪器是( )
A. 漏斗 B. 蒸发皿 C. 酒精灯 D. 玻璃棒
难度: 简单查看答案及解析
-
关于物质分类方法的下列叙述中,不正确的是( )
A.单一分类法是选定某一标准,对物质进行分类的方法
B.交叉分类法是用多种不同的单一分类法对物质进行分类的方法
C.树状分类法是采用树状形式对同类物质进行再分类的方法
D.对于同一组物质,选用不同的分类标准,其分类结果相同
难度: 中等查看答案及解析
-
下列溶液中溶质的物质的量浓度为1mol/L的是( )
A.将40gNaOH溶解在1L水中
B.将1L10mol/L的浓盐酸加入9L水中
C.将22.4LHCl气体溶于水配成1L溶液
D.将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL
难度: 中等查看答案及解析
-
钢铁、铝合金、铜合金三种合金具有广泛的用途,下列说法正确的是( )
A.碳钢与生铁的主要成分相同,所以性能相同
B.镁铝合金可用于制造飞机、汽车等部件
C.铜合金具有优良的导电、导热性能,但耐腐蚀能力较差
D.铝铁合金具有很高的熔点,能用于制造火箭外层材料
难度: 简单查看答案及解析
-
Murad等三位教授关于一氧化氮分子在人体内的独特功能的研究,曾获得诺贝尔医学或生理学奖。关于一氧化氮的下列叙述不正确的是( )
A.一氧化氮是某些含低价氮物质氧化的产物
B.一氧化氮是亚硝酸的酸酐
C.一氧化氮是某些含高价氮物质还原的产物
D.一氧化氮具有还原性,在空气中极易被氧化
难度: 中等查看答案及解析
-
在生产和生活中应用的化学知识正确的是
A. 玻璃、水泥、水晶项链都是硅酸盐制品
B. 晶体硅是在通信工程中制作光导纤维的主要原料
C. 碳酸钠在医疗上是治疗胃酸过多的一种药剂
D. 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
难度: 中等查看答案及解析
-
下列有关环境问题的说法正确的是
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在5.6—7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
难度: 中等查看答案及解析
-
把一小块钠投入盛有煤油和水的烧杯中,可以观察到的现象是( )
A.钠浮在烧杯中的液面上 B.钠沉在烧杯的底部
C.钠会在水和煤油的交界面上下浮动,直到反应结束 D.煤油会燃烧起来,产生很浓的黑烟
难度: 简单查看答案及解析
-
将2.3 g金属钠放入100 g水中,完全反应后溶液的质量分数为
A.
100% B.
100%
C.
100% D.
100%
难度: 简单查看答案及解析
-
用NA代表阿伏加德罗常数,下列说法中正确的是( )
A. 1 mol水含有的氢原子数目为NA B. 1 mol氩气分子所含的原子数目为2NA
C. 0.5 mol碳酸钠中含有的钠离子为0.5NA D. 0.5 mol硝酸中含有的氧原子为1.5NA
难度: 中等查看答案及解析
-
将质量分数为a%,物质的量浓度为c1mol·L-1的稀H2SO4蒸发掉一定量的水,使之质量分数 变为2a%,此时该H2SO4的物质的量浓度为c2mol·L-1,则c1和c2的数值关系是
A.c2=2c1 B.c2>2c1 C.c2<2c1 D.无法确定
难度: 中等查看答案及解析
-
氯化铁溶液与氢氧化铁胶体的共同点是( )
A.分散质颗粒直径都在l~100 nm之间
B.颜色都呈红褐色
C.一束平行光照射溶液时,从侧面都可以看到一束光束
D.都是分散系
难度: 简单查看答案及解析
-
下列关于氯气、液氯、氯水的叙述中正确的是( )
A.氯气、液氯、氯水是同一种物质
B.氯气、液氯、氯水中都含有氯分子
C.氯气、液氯、氯水都是混合物
D.光照条件下,氯水的酸性减弱
难度: 简单查看答案及解析
-
下列各组离子在水溶液中能大量共存的是( )
A.H+ OH-
Na+ B.K+ Mg2+ Cl- Fe2+
C.Ca2+
OH- K+ D.Ba2+
Na+
难度: 简单查看答案及解析
-
将以下4份溶液分别置于如图的装置中,其他条件相同时,灯泡最亮的是( )

A. 100 mL 1 mol·L-1的盐酸
B. 100 mL 2 mol·L-1的蔗糖溶液
C. 100 mL 1 mol·L-1的氯化钠溶液
D. 30 mL 1 mol·L-1的氯化钙溶液
难度: 简单查看答案及解析
-
把浓硫酸滴入浓盐酸中会有氯化氢气体逸出,对此现象的合理解释是( )
A.氯化氢难溶于水
B.浓硫酸是一种高沸点的酸
C.浓硫酸有脱水性
D.浓硫酸溶于水放出大量的热,降低了氯化氢的溶解度
难度: 简单查看答案及解析
-
等质量的镁分别在足量的二氧化碳、氧气中燃烧,有关叙述正确的是( )
A.在二氧化碳中燃烧产生的固体质量大
B.在氧气中产生的氧化镁质量大
C.氧化剂与还原剂物质的量之比都是2∶1
D.反应中都是氧元素被还原
难度: 中等查看答案及解析
-
下列物质中含有的杂质(括号内为杂质),不可以用加热的方法除去的是( )
A.CaCO3(CaO) B.Na2O2(Na2O) C.Na2CO3(NaHCO3) D.MgO[Mg(OH)2]
难度: 中等查看答案及解析
-
查阅以下有关焊锡(锡和铅)和武德合金(铅、铋、锡、镉)组成的合金熔点数据,你能得出的结论是( )
纯金属
合金
铅
镉
铋
锡
焊锡合金
伍德合金
熔点
327
321
271
231
187
70
A.焊锡的熔点比锡和铅的熔点低
B.焊锡的熔点比锡和镉的熔点低
C.焊锡的熔点比锡和铋熔点低
D.焊锡的熔点比铅、镉、铋和锡的熔点都低
难度: 简单查看答案及解析
-
已知反应:①Cl2+2KBr=2KCl+Br2,②KClO3+6HCl=3Cl2+KCl+3H2O,③2KBrO3+Cl2=Br2+2KClO3,下列说法正确的是( )
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C.反应②中还原剂与氧化剂的物质的量之比为6∶1
D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2 mol
难度: 中等查看答案及解析
-
将一定量的钠和铝的混合粉末投入水中,粉末完全溶解后,得到20 mL氢氧根离子为1 mol·L-1的溶液。然后再向其中加入1 mol·L-1的盐酸,到沉淀最大时消耗盐酸40 mL,则混合粉末中钠的物质的量是
A.0.01 mol B.0.02 mol C.0.03 mol D.0.04 mol
难度: 中等查看答案及解析
-
在容积为672 mL的烧瓶中充满NO和NO2的混合气体,将其倒立在水槽里,去塞后再通入280 mL氧气,恰好完全反应,且液体充满烧瓶(气体体积都已折合为标准状况下的体积),下列有关叙述正确的是( )
A. 总反应为NO+NO2+O2+H2O===2HNO3
B. 总反应为4NO+8NO2+5O2+6H2O===12HNO3
C. 生成硝酸的物质的量浓度均为0.030 mol·L-1
D. 生成硝酸的物质的量浓度约为0.060 mol·L-1
难度: 困难查看答案及解析
-
为除去某物质中所含的杂质,周佳敏同学做了以下四组实验,其中她所选用的试剂或操作方法正确的是( )
序号
物质
杂质
除杂试剂或操作方法
①
NaCl溶液
Na2CO3
加入盐酸,蒸发
②
FeSO4溶液
CuSO4
加入过量铁粉并过滤
③
H2
CO2
依次通过盛有NaOH溶液和浓硫酸的洗气瓶
④
NaNO3
CaCO3
加稀盐酸溶解、过滤、蒸发、结晶
A.①②③ B.②③④ C.①③④ D.①②③④
难度: 简单查看答案及解析