-
“天宫一号”目标飞行器与“神舟九号”载人飞船的交会对接,标志着我国具备了建设空间站的基本能力。下列有关说法正确的是
A.火箭升空的动力主要来源于化学能
B.“神舟九号”飞船的太阳能帆板将太阳能直接转换为动能
C.“天宫一号”中的氢氧燃料电池将电能转换为化学能
D.“天宫一号”利用太阳能将水加热分解为氢气和氧气
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.5.6g铁和6.4g铜分别与0.1mol氯气完全反应,转移的电子数相等
B.0.5molO3与11.2LO2所含的分子数一定相等
C.等质量的 14NO和 13CO气体中含有的中子数相等
D.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是
A.Z元素的原子半径可能比Y元素的小
B.Z的原子序数不可能是X的原子序数的2倍
C.W的气态氢化物的稳定性一定比Y的强
D.Z的最高价氧化物的水化物的酸性一定比W的强
难度: 困难查看答案及解析
-
下列说法正确的是:①Cl-的结构示意图
;②羟基的电子式:·····H;③HClO的结构式:H—Cl—O;④NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32—;⑤Na2O的水溶液能导电,这不能说明Na2O是电解质;⑥SiO2既能与氢氟酸反应又能与NaOH溶液反应,故SiO2是两性氧化物;⑦分馏、干馏、裂化都是化学变化
A.①②⑤ B.①④⑥⑦ C.②③④⑥ D.②③⑤⑥⑦
难度: 中等查看答案及解析
-
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-
难度: 困难查看答案及解析
-
水热法制备Fe(FeO2)2纳米颗粒的反应3Fe2++2S2O32-+O2 +xOH-=Fe(FeO2)2+S4O62-+2H2O
下列说法中不正确的是
A.每生成1mol Fe(FeO2)2转移4mol电子 B.该反应中Fe2+和S2O32-都是还原剂
C.3mol Fe2+被氧化时有1molO2被还原 D.反应方程式中化学计量数x=4
难度: 中等查看答案及解析
-
将1000 mL 0.1 mol·L-1 BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1000 mL 0.5 mol·L-1 HCl溶液与足量CH3COONa溶液充分反应放出b kJ热量(不考虑醋酸钠水解);将500 mL 1 mol·L-1 H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为
A.(5a-2b) kJ B.(2b-5a) kJ
C.(5a+2b) kJ D.(10a+4b) kJ
难度: 中等查看答案及解析
-
短周期主族元素A、B、C、D的原子序数依次增大,A、B、C原子的最外层电子数之和为12,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍。下列说法正确的是
A.元素A、C的最高价氧化物对应的水化物都是弱酸
B.元素B的单质能与A的最高价氧化物发生置换反应
C.元素B和D能形成BD2型的共价化合物
D.D的氢化物有毒,且有漂白性
难度: 困难查看答案及解析
-
来自法国格勒诺布尔(Grenoble)约瑟夫·傅立叶大学的研究小组发明了第一块可为人体人造器官提供电能的可植入的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生的总反应为C6H12O6+6O2=6CO2+6H2O(酸性环境),下列对该电池说法不正确的是
A.该生物燃料电池不可以在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
C.消耗1mol氧气则转移4mole-,H+会向负极移动
D.今后的研究方向是怎样提高葡萄糖生物燃料电池的效率,从而在将来达到可以利用葡萄糖生物燃料电池为任何可植入医疗设备提供电能
难度: 中等查看答案及解析
-
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
①N2(g) + 2O2(g) =2 NO2(g) ΔH = +67.7kJ/mol
②2N2H4(g) + 2NO2(g) =3N2(g) + 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
A.N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O = N2H5+ + OH-
C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4 -4e- + 4OH- = N2 + 4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大
难度: 中等查看答案及解析
-
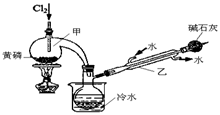
如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是
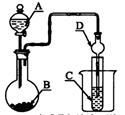
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色
B.若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色
D.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀
难度: 中等查看答案及解析
-
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
A.自然界中没有游离态的钠和铝
B.铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出
D.m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小
难度: 中等查看答案及解析
-
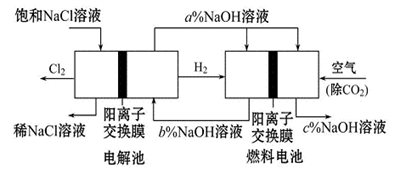
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是

A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶3∶2
C.欲用(丙)装置给铜镀银,G应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷
难度: 中等查看答案及解析
-
玻璃棒是化学实验中常用的仪器,其可用于搅拌、过滤或转移液体时引流。下列有关实验过程中,一般不需要使用玻璃棒进行操作的是:①用pH试纸测定Na2CO3溶液的pH ②从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl ③实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀 ④用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验 ⑤将适量氢氧化铁饱和溶液滴入沸水中制氢氧化铁胶体 ⑥用适量的蔗糖、浓硫酸和水在小烧杯中进行验证浓硫酸具有脱水性的实验 ⑦探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
A.②③⑦ B.③④⑤ C.⑤⑥⑦ D.④⑥⑦
难度: 中等查看答案及解析
-
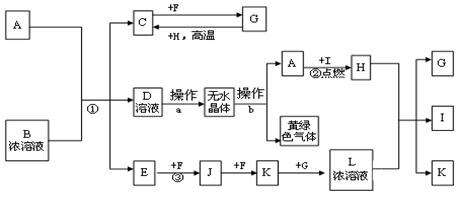
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X是①Na2CO3溶液和稀盐酸 ②Cl2和Fe ③C和O2 ④SO2和NaOH溶液 ⑤AlCl3溶液和NaOH溶液
A.①②③④均可以 B.②③④⑤均可以
C.①②③⑤ 均可以 D.①②③④⑤均可以
难度: 中等查看答案及解析
-
下列各图与表述一致的是
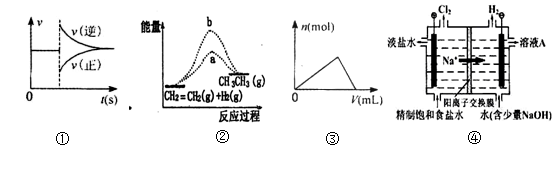
A.图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.图②b曲线表示反应CH2=CH2(g)+H2(g)→CH3-CH3(g)ΔH <0,使用催化剂时,反应过程中的能量变化
C.曲线图③可以表示向一定量的氢氧化钠溶液中滴加一定浓度氯化铝溶液时产生沉淀的物质的量变化
D.图④电解饱和食盐水的装置中阴极的电极反应式为:2H++ 2e- = H2↑
难度: 中等查看答案及解析