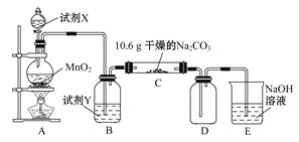
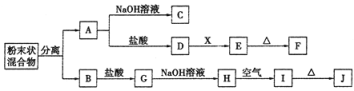
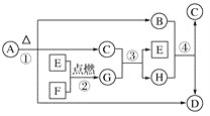
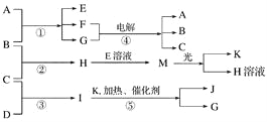
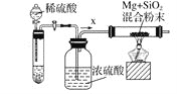
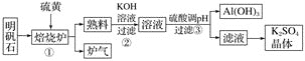
-
三种都能与酸反应的金属混合物共2.3 g,与足量的稀盐酸反应,生成氢气0.1 g,则这三种金属可能是( )
A. Cu、Na、Al B. Zn、Na、Fe
C. Mg、Na、Al D. Zn、Na、Al
难度: 中等查看答案及解析
-
下列有关叙述正确的是( )
A. 电泳现象可证明胶体带电荷
B. 直径在1~100 nm之间的粒子称为胶体
C. 是否具有丁达尔效应是溶液和胶体的本质区别
D. 胶体粒子很小,可以透过滤纸
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A. SO2的摩尔质量为64 g
B. 气体的摩尔体积约为22.4 L·mol-1
C. 12 g12C中所含碳原子数即为阿伏加德罗常数
D. 4 g NaOH溶于1 L水所得溶液的物质的量浓度为0.1 mol·L-1
难度: 简单查看答案及解析
-
下列各组在溶液中的反应,不管反应物的量是多少,都能用同一离子方程式表示的是( )
A.NaOH与CO2 B.Ba(OH)2与H2SO4
C.HCl与Na2CO3 D.NaHSO4与Ba(OH)2
难度: 中等查看答案及解析
-
在水泥厂、冶金厂常用高压电作用于气溶胶,以除去大量烟尘,减少烟尘对空气的污染。这种除尘法的原理是( )
A.渗析 B.电泳 C.聚沉 D.丁达尔效应
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 氧化剂本身发生氧化反应
B. 氧化还原反应一定有氧元素参加
C. 氧化剂在反应中得电子,还原剂失去电子
D. 氧化反应一定先于还原反应发生
难度: 简单查看答案及解析
-
关于硫酸铜的下列说法中不正确的是( )
A.无水硫酸铜是一种白色粉末
B.硫酸铜俗称蓝矾、胆矾
C.蓝矾的摩尔质量为250g·mol-1
D.实验室常用无水硫酸铜检验水的存在
难度: 简单查看答案及解析
-
在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是
A.Ag B.Cu C.Mg D.H2
难度: 简单查看答案及解析
-
在下列化学方程式中,不能用离子方程式Ba2++SO42-=BaSO4↓来表示的是( )
A.BaCl2+Na2SO4=BaSO4↓+2NaCl B.Ba(OH)2+H2SO4=BaSO4↓+2H2O
C.BaCl2+H2SO4=BaSO4↓+2HCl D.Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
难度: 简单查看答案及解析
-
下列关于反应KClO3+6HCl=KCl+3Cl2↑+2H2O的说法不正确的是( )
A.KClO3是氧化剂 B.H2O既不是氧化产物也不是还原产物
C.HCl是还原剂 D.KCl既是还原产物也是氧化产物
难度: 简单查看答案及解析
-
下列各组物质中氮元素的化合价由低到高的排列顺序是( )
A. N2、NH3、NO2
B. NH3、N2O5、NO2
C. N2、N2O3、NH3
D. NH3、N2、N2O3
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列说法中正确的是( )
A. 18 g H2O所含的分子数为NA B. 22.4 L H2O所含的分子数为NA
C. NA个氢原子的质量为2 g D. 1 mol NaCl中含0.5NA个Na+和0.5NA个Cl﹣
难度: 中等查看答案及解析
-
下列气体中,无色有毒、能污染大气,能用碱液吸收的是( )
A.一氧化碳 B.二氧化碳 C.二氧化硫 D.氯气
难度: 简单查看答案及解析
-
氧化钠为碱性氧化物,二氧化硫是酸性氧化物,根据其类别推测二氧化硫不具有的性质是 ( )
A. 与氧化钠反应生成亚硫酸钠
B. 与足量的氢氧化钾反应生成亚硫酸钾和水
C. 与盐酸反应
D. 与足量的石灰水反应生成亚硫酸钙和水
难度: 简单查看答案及解析
-
查阅以下有关焊锡(锡和铅)和武德合金(铅、铋、锡、镉)组成的合金熔点数据,你能得出的结论是( )
纯金属
合金
铅
镉
铋
锡
焊锡合金
伍德合金
熔点
327
321
271
231
187
70
A.焊锡的熔点比锡和铅的熔点低
B.焊锡的熔点比锡和镉的熔点低
C.焊锡的熔点比锡和铋熔点低
D.焊锡的熔点比铅、镉、铋和锡的熔点都低
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 硫酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等
B. 6.02×1023个N2和6.02×1023个O2的质量比等于7∶8
C. 3.2 g O2所含的原子数目约为0.2×6.02×1023
D. 常温、常压下,0.5×6.02×1023个二氧化碳分子质量是44 g
难度: 中等查看答案及解析
-
在溶液中能大量共存的离子组是( )
A.Ag+ Cl- Na+ B.H+ OH- K+
C.K+
Ca2+ D.Al3+ OH- Cl-
难度: 中等查看答案及解析
-
一种盐X与烧碱混合共热,可放出无色气体Y,Y经一系列氧化后再溶于水可得Z溶液,Y和Z反应又生成X,则X是( )
A.硫酸铵 B.硝酸铵 C.氯化铵 D.碳酸氢铵
难度: 中等查看答案及解析
-
下列叙述正确的是
A.1 mol任何气体的体积都为22.4 L
B.1 mol任何物质在标准状况下所占的体积都为22.4 L
C.只有在标准状况下,气体摩尔体积才约为22.4 L·mol-1
D.标准状况下,22.4 L任何气体的物质的量都是1 mol
难度: 简单查看答案及解析
-
若从水溶液中获取下列物质,可选用关于蒸发结晶的是( )
A.氯化氢 B.酒精 C.食盐 D.铜粉
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A. 向NaOH溶液中通入少量的SO2:SO2+OH-===
B. 向新制氯水中通入少量的SO2:Cl2+SO2+2H2O===4H++2Cl-+
C. 将SO2通入饱和NaHCO3溶液:2H++
===H2O+CO2↑
D. 将SO2通入BaCl2溶液:SO2+H2O+Ba2+===BaSO3↓+2H+
难度: 简单查看答案及解析
-
下列关于硝酸性质的说法不正确的是( )
A.硝酸能与水易任意比互溶
B.质量分数足够大时可形成发烟硝酸
C.不易挥发,有刺激性气味
D.浓硝酸因分解生成的二氧化氮又溶于硝酸而呈黄色
难度: 中等查看答案及解析
-
下列关于分散系的说法不正确的是
A.分散系的稳定性:溶液>胶体>浊液
B.分散质粒子的大小:溶液>胶体>浊液
C.分散质粒子的直径为几纳米或几十纳米的分散系是胶体
D.可以用过滤的方法将悬浊液中的分散质从分散剂中分离出来
难度: 简单查看答案及解析
-
下列电离方程式书写正确的是( )
A.NaOH=Na++O2-+H+ B.FeCl3=Fe3++
C.Ca(NO3)2=Ca2++2(NO3)2- D.H2SO4=2H++
难度: 简单查看答案及解析
-
在容积为672 mL的烧瓶中充满NO和NO2的混合气体,将其倒立在水槽里,去塞后再通入280 mL氧气,恰好完全反应,且液体充满烧瓶(气体体积都已折合为标准状况下的体积),下列有关叙述正确的是( )
A. 总反应为NO+NO2+O2+H2O===2HNO3
B. 总反应为4NO+8NO2+5O2+6H2O===12HNO3
C. 生成硝酸的物质的量浓度均为0.030 mol·L-1
D. 生成硝酸的物质的量浓度约为0.060 mol·L-1
难度: 困难查看答案及解析