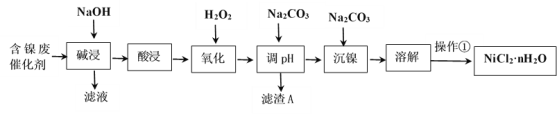
-
化学与生产、生活息息相关。下列说法正确的是( )
A.可用钢瓶储存液氯或浓硫酸
B.二氧化碳气体可用作镁燃烧的灭火剂
C.鸡蛋清溶液中加入CuSO4溶液,有沉淀析出,该性质可用于蛋白质的分离与提纯
D.炒菜时加碘食盐要在菜准备出锅时添加,是为了防止食盐中的碘受热升华
难度: 中等查看答案及解析
-
设NA 为阿伏加德罗常数的值,下列说法正确的是( )
A.1mol SiO2 所含Si-O键的数目为 2 NA
B.常温下,1 L pH=9的CH3COONa 溶液中由水电离的H+ 数目为 10-9 NA
C.40 mL 10 mol/L浓盐酸与足量MnO2充分反应,生成的氯气分子数为 0.1NA
D.标准状况下,11.2 L 甲烷和乙烯混合物中含氢原子数目为2NA
难度: 中等查看答案及解析
-
由下列“实验操作和现象”与“结论”均正确的( )
选项
实验操作及现象
结论
A
将含铁的氧化物的砖块用盐酸浸取,浸取液能使KMnO4溶液褪色
浸取液中含Fe2+
B
常温下,测得饱和Na2CO3 溶液的pH大于饱和NaHCO3 溶液的pH
常温下水解程度
>
C
25℃时,向AgNO3溶液中滴加足量NaCl溶液至不再产生沉淀,然后滴加KI溶液,有黄色沉淀生成
25℃时,Ksp(AgCl)>Ksp(AgI)
D
将Cl2通入滴有酚酞的NaOH溶液后,溶液褪色
Cl2具有漂白性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
有机物X、Y的转化如下:
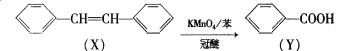
下列说法不正确的是
A.X能加聚反应
B.Y分子苯环上的二氯代物有5种
C.
与Y互为同分异构体
D.X、Y分子的所有原子可能共平面
难度: 中等查看答案及解析
-
图甲是一种利用微生物将废水中的尿素(CO(NH2)2)转化为环境友好物质的原电池装置示意图甲,利用该电池在图乙装置中的铁上镀铜。下列说法正确的是( )

A.图乙中Fe电极应与图甲中Y相连接
B.图甲中H+透过质子交换膜由右向左移动
C.图甲中M电极反应式:CO(NH2)2 +5H2O -14e− = CO2+2NO2+14H+
D.当图甲中N电极消耗0.5 mol O2时,图乙中阴极增重64g
难度: 困难查看答案及解析
-
X、Y、Z、W 为短周期主族元素,且原子序数依次增大。X 原子中只有一个电子,Y 原子的L电子层有5个电子,Z元素的最高化合价为其最低化合价绝对值的3倍。下列叙述正确的是( )
A.简单离子半径:W >Z> Y
B.Y的气态氢化物与W的气态氢化物相遇有白烟产生
C.X、Y、Z三种元素形成的化合物只含共价键
D.含氧酸的酸性:W的一定强于Z的
难度: 困难查看答案及解析
-
已知:pOH=-lgc(OH-)。室温下,将稀盐酸滴加到某一元碱(BOH)溶液中,测得混合溶液的pOH 与微粒浓度的变化关系如图所示。 下列说法错误的是( )
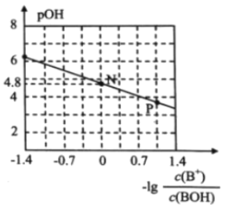
A.若向0.1mol/L BOH溶液中加水稀释,则溶液中c(OH-)/c(BOH) 增大
B.室温下,BOH的电离平衡常数K = 1×10-4.8
C.P点所示的溶液中:c(Cl-) > c(B+)
D.N点所示的溶液中: c(H+) = c(Cl-) + c(OH-) - c(BOH)
难度: 困难查看答案及解析