-
下列说法不正确的是
A.在研究氯气的性质吋,发现有刺激性气味,该过程使用了观察法
B.可以用分类的方法预测物质的性质
C.化学反应可以创造新的原子和分子用于合成新的物质
D.合成大量自然界不存在的新物质是现代化学的重要任务之一
难度: 中等查看答案及解析
-
下列关于钠的说法不正确的是
A.金属钠与氧气反应,条件不同产物不同
B.金属钠着火不可用泡沫灭火器灭火
C.少量的钠可保存在煤油中
D.钠的化学性质活泼,可从CuSO4溶液中置换出Cu
难度: 简单查看答案及解析
-
下列说法中不正确的是
A.漂白粉可以用于生活用水的消毒
B.石蕊溶液滴入氯水中,溶液变红,随后迅速褪色
C.氯气通入水中杀菌消毒,发生了化学变化
D.漂白粉在空气中久置变质,原因是原白粉中的CaCl2与空气中的CO2反应生成CaCO3
难度: 中等查看答案及解析
-
设NA表示阿伏加徳常数,下列说法中正确的是
A.标准状况下,2.24LCO和CO2混合气体中含有的碳原子数目为0.2NA
B.在非标准状况下,1mol任何气体的体积不可能是22.4NA
C.常温常圧下,32gO2和O3的混合气休含有的氧原子数2NA
D.1molH2SO4中所含的粒子数目一定是NA
难度: 中等查看答案及解析
-
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是( )
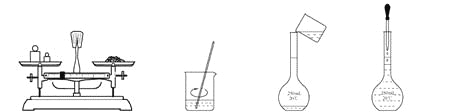
A. 称量 B. 溶解 C. 转移 D. 定容
难度: 中等查看答案及解析
-
将0.01mol下列物质分别加入l00mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2 ②Na2O ③Na2SO4 ④NaCl
A.①>②>③>④ B.①>②>④>③ C.①=②>③>④ D.①=②>③=④
难度: 中等查看答案及解析
-
在一密闭容器中有CO、H2、O2共16.5g,用电火花引燃,使其完全燃烧,再将燃烧后的气体用Na2O2充分吸收,Na2O2增重7.5g,则原混合气体中O2的质量分数是( )
A.36% B.54.5% C.40% D.33.3%
难度: 简单查看答案及解析
-
下图表示了x、y、z 事物间的从属关系,下列选项中不符合图中事物间从属关系的是
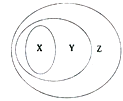
X
Y
Z
例
氧化物
化合物
纯净物
A
中和反应
复分解反应
化学反应
B
电解质
盐
化合物
C
胶体
分散系
混合物
D
碱性氧化物
金属氧化物
氧化物
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
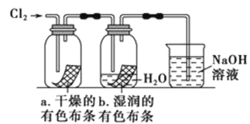
探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论正确的是
A.新制饱和氯水使红玫瑰变力白玫瑰,说明含有Cl2
B.加入石蕊溶液,溶液变红,说明该溶液不含HC1O
C.光照新制氯水有气泡逸出,该气体是氧气
D.向氯水中KHCO3粉末有气泡产生,说明绿水中含有HC1O
难度: 中等查看答案及解析
-
下列说法中不正确的是
A.常温常压下,28gCO与N2的混合气体所含有的原子数为2NA
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1
C.同温同压下,相同质量的二氧化碳和二氧化硫的体积是16:11
D.常温常压下,0.5×6.02×1023一氧化碳分子所占体积是11.2L
难度: 中等查看答案及解析
-
将0.1mol/L的K2SO4溶液、0.2mol/L的Al2(SO4)3溶液和纯水混合,要使混合液中K+、Al3+、 SO42-的浓度分别为0.1mol/L、0.1mol/L、0.2mol/L,则所取三者的体积比是(假定混合后的体积不变)( )
A.1:1:1 B.2:1:2 C.1:1:2 D.2:1:1
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是
A.氨气通入醋酸 CH3COOH+NH3= CH3COO-+NH4+
B.碳酸氢镁溶液中加过量石灰水 Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+H2O+MgCO3↓
C.澄清石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
D.稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
难度: 困难查看答案及解析
-
下列说法中正确的是
①酸性氧化物在一定条件下均能与碱发生反应
②金属氧化物不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物
③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
④硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
⑤因为胶粒比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离出来
⑥氢氧化铁胶体稳定存在的主要原因是胶粒直径介于Inm到l00nm之间
A.3个 B.4个 C.5个 D.6个
难度: 困难查看答案及解析
-
两个体积相同的密闭容器一个盛有氯化氢,另一个盛有H2和Cl2的混合气体,在同温同压下,两个容器内的气体一定具有相同的
A.质量 B.密度 C.分子总数 D.质子总数
难度: 中等查看答案及解析
-
下列说法中错误的是
A.10 g 98%的硫酸溶液(密度为l.84g/cm3)与10mL 18.4 mol·L-的硫酸溶液的浓度不相同
B.制成0.5 L 10 mol·L-1的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol·L-11BaCl2溶液中,Ba2+和 C1-总数为 3×6.02×1023
D.从1 L 1 mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1
难度: 中等查看答案及解析
-
若10g密度为dg/cm3的氣化钙溶液里含2gCa2+,则Cl-的物质的量浓度是
A.
B.
C.
D.
难度: 中等查看答案及解析