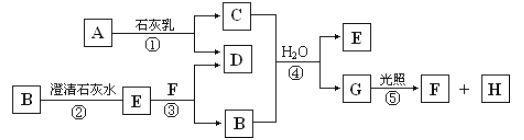
-
下列化学反应的离子方程式正确的是( )
A. 用稀HNO3溶解FeS固体:FeS+2H+===Fe2++H2S↑
B. 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-===CaSO3↓+2HClO
C. 在稀氨水中通入过量CO2:NH3·H2O+CO2===NH4++HCO3-
D. 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-===CaSO4↓+H2O
难度: 简单查看答案及解析
-
关于物质的类别,下列说法正确的是
A.食盐水、糖水、冰水都属于混合物
B.烧碱、火碱、消石灰都属于碱
C.KHSO4、HCl、HNO3在水中都能电离出氢离子,都属于酸
D.溶液、胶体、浊液都属于稳定的分散系
难度: 简单查看答案及解析
-
下列各项操作中,错误的是( )
A. 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液
B. 进行萃取操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C. 萃取分液前需对分液漏斗检漏
D. 为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下
难度: 简单查看答案及解析
-
在下列化学方程式中,不能用离子方程式Ba2++SO42-=BaSO4↓来表示的是( )
A.BaCl2+Na2SO4=BaSO4↓+2NaCl B.Ba(OH)2+H2SO4=BaSO4↓+2H2O
C.BaCl2+H2SO4=BaSO4↓+2HCl D.Ba(NO3)2+H2SO4=BaSO4↓+2HNO3
难度: 简单查看答案及解析
-
多数合金与组成成分相比较,合金的
A.性能差 B.密度大
C.熔点高,硬度小 D.熔点低,硬度大
难度: 简单查看答案及解析
-
下列各组反应中,硝酸既表现了氧化性,又表现了酸性的是
A.C+HNO3 B.H2S+HNO3 C.Fe(OH)3+HNO3 D.Cu+HNO3
难度: 简单查看答案及解析
-
铝、氧化铝、氢氧化铝和可溶性铝盐溶液分别与过量的强碱溶液反应,其生成物有一定的规律。下列说法正确的是( )
A.都有水生成 B.都有氢气生成 C.都有偏铝酸盐生成 D.都有铝盐生成
难度: 中等查看答案及解析
-
下列物质:①氯水 ②氯化氢气体 ③盐酸 ④融熔氯化钠 ⑤氯酸钾溶液 ⑥四氯化碳,其中不含氯离子的是
A.①②③ B.②④⑥ C.②⑤⑥ D.③④⑤
难度: 简单查看答案及解析
-
有两瓶失去标签的无色液体,一瓶是饱和氯化钠溶液,一瓶是蒸馏水。为了把它们区分开,同学们提出了以下方法:①蒸发、②测密度、③测导电性、④测pH、⑤加入氯化钠、⑥加入食醋。你认为可行的是( )
A. ①②③⑤ B. ①③④⑤ C. ②③④⑥ D. ②③⑤⑥
难度: 中等查看答案及解析
-
同温同压下,相同物质的量的铝、铁分别与足量盐酸反应时,放出氢气的体积比是( )
A.1∶1 B.3∶1 C.3∶2 D.2∶3
难度: 中等查看答案及解析
-
下列变化不能通过一步化学反应实现的是( )
A.BaCl2→BaSO4 B.CuO→Cu(OH)2
C.NaOH→Na2CO3 D.MgSO4→Mg(OH)2
难度: 中等查看答案及解析
-
与
的混合气体5g,在
时和足量的氧气混合,用电火花充分引燃,在相同状况下再将反应后所得混合气体通入到足量的
中,测得
固体增重的质量为
,则原混合气体中
的质量分数为( )
A.25% B.75% C.88% D.32%
难度: 中等查看答案及解析
-
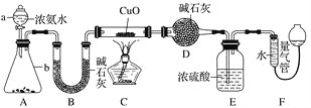
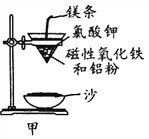
某化学兴趣小组利用MnO2和浓HCl及如图装置制备Cl2。下列分析中不正确的是 ( )。
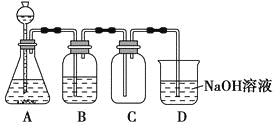
A.A中可用分液漏斗代替长颈漏斗
B.A中缺少加热装置
C.B中盛放的NaOH溶液可以净化Cl2
D.D中的导管口若连接倒置漏斗可防止倒吸
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.澄清石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH﹣=CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:H++SO42-+Ba2++OH﹣=BaSO4↓+2H2O
C.向氢氧化钠溶液中通入足量:CO2+2OH﹣+CO2=CO32-+H2O
D.向氢氧化钡溶液中加入过量硫酸:2H++SO42-+Ba2++2OH﹣=BaSO4↓+2H2O
难度: 中等查看答案及解析
-
标准状况下,700 L氨气溶于1 L水得到密度为0.9 g·cm-3的饱和氨水,则该氨水的物质的量浓度约为( )
A.16.4 mol·L-1 B.17.4 mol·L-1 C.18.4 mol·L-1 D.19.4 mol·L-1
难度: 中等查看答案及解析
-
在10﹣9m~l0﹣7m范围内,对原子、分子进行操纵的纳米超分子技术往往能实现意想不到的变化。纳米铜颗粒一遇到空气就会剧烈燃烧,甚至发生爆炸。列说法正确的是( )
A.纳米铜是一种新型化合物
B.纳米铜颗粒比普通铜更易与氧气发生反应
C.纳米铜与普通铜所含铜原子的种类不同
D.纳米铜无需密封保存
难度: 中等查看答案及解析
-
将ag某物质在足量氧气中充分燃烧再将气体生成物通入足量的Na2O2充分反应,固体增重为bg,若a<b,则该物质可能是( )
A. H2 B. CO C. 乙酸(CH3COOH) D. 甲烷(CH4)
难度: 中等查看答案及解析
-
明矾净水的作用是( )
A.除去水中氯离子 B.除去水中钙离子
C.除去水中悬浮物 D.消毒杀菌
难度: 简单查看答案及解析
-
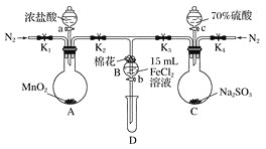
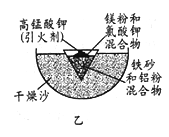
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
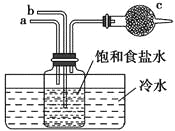
A. a通入CO2,然后b通入NH3,c中放碱石灰
B. b通入NH3,然后a通入CO2,c中放碱石灰
C. a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
D. b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
难度: 中等查看答案及解析
-
用以下三种途径来制取相同质量的硝酸铜:①铜跟浓硝酸反应,②铜跟稀硝酸反应,③铜跟氧气反应生成氧化铜,氧化铜再跟稀硝酸反应。以下叙述正确的是( )
A.三种途径所消耗的铜的物质的量不相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗铜的物质的量:途径③>途径①>途径②
D.所消耗硝酸的物质的量:途径①>途径②>途径③
难度: 中等查看答案及解析
-
如图所示,在烧杯中加入水和苯(苯的密度为0.88g·cm-3,与水互不相溶,且不与钠反应)各50mL,将一小粒金属钠(密度为0.97g·cm-3)投入烧杯中,观察到的现象为( )
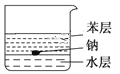
A.钠在水层中反应并四处游动
B.钠停留在苯层中不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯与水的界面处反应并不断上浮、下沉
难度: 简单查看答案及解析
-
某溶液中存在较多的H+、SO42-、NO3-,则该溶液中还可能大量存在的离子组是
A.Mg2+、NH4+、Cl- B.Mg2+、Ba2+、Br-
C.Na+、Cl-、I- D.Al3+、HCO3-、Cl-
难度: 中等查看答案及解析
-
将下列各组物质按单质、氧化物、酸、碱分类顺序排列,其中正确的是( )
A.氧气、干冰、硫酸、烧碱 B.碘酒、冰、盐酸、烧碱
C.氢气、二氧化硫、硝酸、纯碱 D.铜、硫酸钠、醋酸、石灰水
难度: 中等查看答案及解析
-
下列各物质的溶液不能与二氧化碳反应的是( )
A.氯化铝 B.偏铝酸钠 C.硅酸钠 D.碳酸钠
难度: 简单查看答案及解析
-
在甲、乙两烧杯溶液中,共含有大量的Cu2+、K+、H+、NO3-、CO32-、OH-。已知两烧杯中各含三种离子,且甲烧杯的溶液呈蓝色,则乙烧杯中大量存在的离子是( )
A.Cu2+ H+ NO3- B.K+ CO32- OH-
C. CO32- OH- NO3- D.K+ H+ NO3-
难度: 简单查看答案及解析