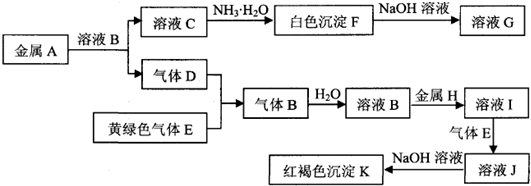
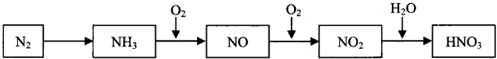
-
下列反应类型中,一定不属于氧化还原反应的是( )
A.化合反应
B.置换反应
C.分解反应
D.复分解反应难度: 中等查看答案及解析
-
当光束通过下列分散系时,能观察到丁达尔效应的是( )
A.蔗糖溶液
B.盐酸
C.氯化钠溶液
D.Fe(OH)3胶体难度: 中等查看答案及解析
-
氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应的化学方程式如下:CaH2+2H2O═Ca(OH)2+2H2↑,其中水是( )
A.氧化剂
B.还原剂
C.既是氧化剂,又是还原剂
D.既不是氧化剂也不是还原剂难度: 中等查看答案及解析
-
氧化还原反应的实质是( )
A.电子转移
B.元素化合价变化
C.氧元素参加反应
D.原子重新组合难度: 中等查看答案及解析
-
下列物质中,既能跟盐酸反应,又能跟NaOH溶液反应的是( )
A.Mg
B.Al
C.Si
D.Cl2难度: 中等查看答案及解析
-
下列气体中,不会造成空气污染的是( )
A.N2
B.SO2
C.NO
D.Cl2难度: 中等查看答案及解析
-
下列物质中,不属于合金的是( )
A.碳素钢
B.水银
C.黄铜
D.硬铝难度: 中等查看答案及解析
-
下列物质中,属于电解质的是( )
A.酒精
B.铜
C.氯化钠
D.盐酸难度: 中等查看答案及解析
-
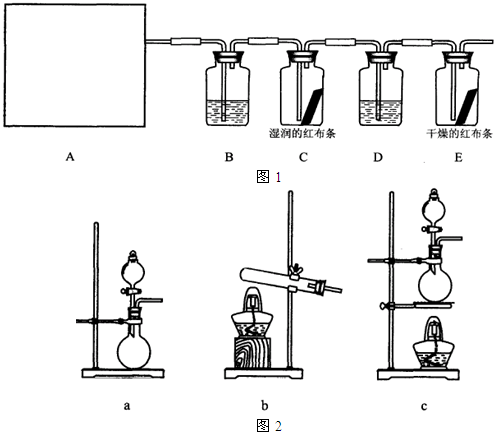
下列常用的实验仪器中,能直接加热的是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
下列气体中,极易溶于水的是( )
A.O2
B.NH3
C.CO2
D.Cl2难度: 中等查看答案及解析
-
下列气体中,摩尔质量最大的是( )
A.H2
B.O2
C.CO
D.NH3难度: 中等查看答案及解析
-
下列变化中,需加入适当的氧化剂才能完成的是( )
A.Fe→FeCl2
B.CuO→Cu
C.SO3→H2SO4
D.HNO3→NO难度: 中等查看答案及解析
-
下列溶液中,常温下可以用铁罐装运的是( )
A.浓盐酸
B.稀硝酸
C.浓硫酸
D.硫酸铜溶液难度: 中等查看答案及解析
-
下列有关物质用途的说法中,不正确的是( )
A.明矾可用作净水剂
B.氧化钠可作潜水艇中的供氧剂
C.氢氟酸可用来刻蚀玻璃
D.漂白粉可用作游泳池的消毒剂难度: 中等查看答案及解析
-
取一小块金属钠放在滴有酚酞的水中,下列实验现象正确的是( )
①钠浮在水面迅速反应 ②钠沉在水底迅速反应 ③钠熔成小球并快速游动 ④反应后的溶液变为红色 ⑤反应中可以听到嘶嘶的响声.
A.①④⑤
B.②③⑤
C.②③④⑤
D.①③④⑤难度: 中等查看答案及解析
-
下列有关物质分离方法的叙述中,不正确的是( )
A.用过滤的方法分离溶液和胶体
B.用蒸馏的方法将自来水制成蒸馏水
C.用四氯化碳萃取碘水中的碘
D.用加热的方法分离氯化钠和氯化铵固体难度: 中等查看答案及解析
-
欲除去Fe2O3中混有的少量Al2O3,可选用的试剂是( )
A.水
B.稀硝酸
C.稀硫酸
D.氢氧化钠溶液难度: 中等查看答案及解析
-
下列各组离子在溶液中能大量共存的是( )
A.Ca2+、Na+、CO32-、NO3-
B.Na+、Cl-、HCO3-、OH-
C.Na+、Al3+、Cl-、SO42-
D.H+、K+、HCO3-、SO42-难度: 中等查看答案及解析
-
下列有关硅及其化合物用途的说法中,不正确的是( )
A.硅单质是制造玻璃的主要原料
B.硅酸凝胶经处理后可作干燥剂
C.硅酸钠是制木材防火剂的原料
D.二氧化硅是制造光导纤维的材料难度: 中等查看答案及解析
-
下列有关氢氧化亚铁及其制备方法的叙述中,不正确的是( )
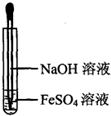
A.氢氧化亚铁易被空气氧化
B.氢氧化亚铁为灰绿色絮状沉淀
C.可利用如图所示装置,制备氢氧化亚铁
D.实验制备中,氢氧化钠溶液应预先煮沸难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.钠与水反应 Na+H2O═Na++OH-+H2↑
B.铜与稀硝酸反应 Cu+NO3-+4H+═Cu2++2NO2↑+2H2O
C.实验室制备氢氧化铝 Al3++3NH3•H2O═Al(OH)3↓+3NH4+
D.向氯化铁溶液中加入过量铁粉 Fe3++Fe═2Fe2+难度: 中等查看答案及解析
-
在试管中注入某红色溶液,加热,溶液颜色逐渐变深,则原溶液可能是( )
①滴有石蕊的H2SO4溶液 ②滴有酚酞的氨水 ③溶有SO2的品红溶液.
A.①②
B.②③
C.①③
D.只有②难度: 中等查看答案及解析
-
只用一种试剂可区别四种溶液Na2SO4、FeCl2、Al2(SO4)3、(NH4)2SO4,此试剂是( )
A.BaCl2溶液
B.稀H2SO4
C.NaOH浓溶液
D.AgNO3溶液难度: 中等查看答案及解析
-
除去粗盐溶液中的Ca2+、Mg2+、SO42-等杂质,需依次加入稍过量的NaOH溶液、X溶液、Y溶液,最终滴加稀盐酸调至中性.其中X、Y分别是( )
A.Na2CO3,Ba(NO3)2
B.Na2CO3,AgNO3
C.Na2CO3,BaCl2
D.BaCl2,Na2CO3难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数.下列有关NA的叙述中,正确的是( )
A.标准状况下,22.4 L水所含的水分子数为NA
B.1 mol过氧化钠与水反应时,失去电子的数目为2NA
C.25℃,1.01×105Pa,64 g二氧化硫中含有的原子数为3NA
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4难度: 中等查看答案及解析