-
化学与生活密切相关,下列有关说法错误的是
A.新能源汽车的推广与使用,有助于减少光化学烟雾的产生
B.氯气泄漏时,可用蘸有肥皂水的湿毛巾捂住口鼻疏散到安全区域
C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈
D.地球上99%的溴元素以Br-形式存在于海水中,溴化钠和溴化钾在医药上常用作镇静剂
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.四氯化碳分子的球棍模型:
B.氢硫酸的电离:H2S
2H++S2-
C.溴化铵的电子式:NH4+
D.含78个中子的碘原子:
I
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
A.6.0gSiO2晶体中含有共价键的个数为0.2NA
B.标准状况下,11.2LSO2与22.4LO2反应,生成的SO3分子个数小于0.5NA
C.MnO2与足量浓盐酸反应生成标准状况下11.2LCl2,转移电子数为NA
D.室温下,53.5gNH4Cl晶体溶于氨水中,所得溶液pH=7,NH4+的数目为NA
难度: 中等查看答案及解析
-
下列关于有机物的叙述不正确的是
A.分子式为C4H8O2的酯有4种结构
B.主链含5个碳原子,有甲基、乙基2个支链的烷烃有3种
C.丙烯分子中最多有7个原子共平面
D.乙烯和溴的四氯化碳溶液反应生成1,2二溴乙烷
难度: 中等查看答案及解析
-
X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是
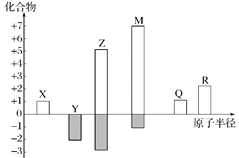
A.Q位于第三周期ⅠA族
B.X、Y、Z三种元素组成的化合物可能是盐或碱
C.简单离子半径:M->Q+>R2+
D.Z与M的最高价氧化物对应水化物均为强酸
难度: 困难查看答案及解析
-
锌银电池的负极为锌,正极为氧化银,电解质是KOH,电池反应为Zn+Ag2O+H2O
Zn(OH)2+2Ag。以锌银电池为电源,电解硫酸镍溶液冶炼纯镍,装置如图所示。
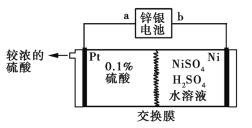
下列说法正确的是
A.装置中使用阳离子交换膜
B.锌银电池a极反应式为Ag2O+H2O+2e-
2Ag+2OH-
C.镍极的主要反应为2H++2e-
H2↑
D.若锌银电池溶解13 g锌,则镍极净增质量最多为5.9 g
难度: 中等查看答案及解析
-
25℃时,NH3·H2O的电离平衡常数Kb=2×10-5mol·L-1,将0.5mol(NH4)2SO4溶于水中,向所得溶液中滴加aL氨水后溶液呈中性,据此判断下列说法中不正确的是( )
A.滴加氨水的过程中,水的电离平衡将正向移动
B.滴加aL氨水后的溶液中,n(NH4+)=200n(NH3·H2O)=1mol
C.所滴加氨水的浓度为
mol·L-1
D.滴加aL氨水后的溶液中各离子浓度大小为c(NH4+)=2c(SO42-)>c(H+)=c(OH-)
难度: 困难查看答案及解析
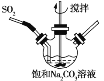
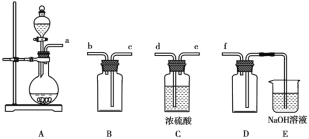

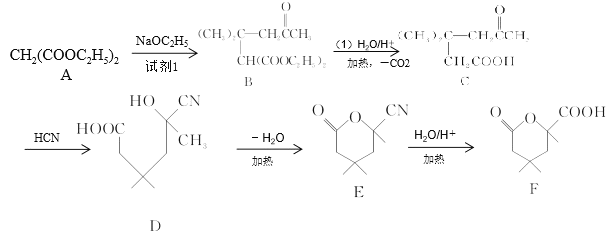
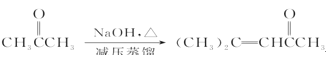 (试剂1)
(试剂1)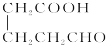 的合成路线(其他试剂任选)。_______。
的合成路线(其他试剂任选)。_______。