-
化学与环境、工农业生产等密切相关,下列叙述正确的是网( )
A.光化学烟雾与大量排放碳氢化合物和氮氧化合物有关
B.将草木灰和硫酸铵混合施用,肥效更高
C.棉花、蚕丝和锦纶的主要成分都是纤维素
D.硫酸工业尾气未经处理就直接排放,将直接导致“温室效应”难度: 中等查看答案及解析
-
下列说法正确的是( )
A.可用碘水鉴别苯、四氯化碳、乙醇三种无色液体
B.取11.7gNaCl固体于烧杯中,加入200mL蒸馏水(ρ=1g/cm3)充分搅拌可配成1mol/L的NaCl溶液
C.测定溶液的酸碱性时,应先将pH试纸润湿,然后进行检测
D.为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等难度: 中等查看答案及解析
-
在相同温度和压强下,对反应CO2(g)+H2(g)⇌CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见表:
上述四种情况达到平衡后,n(CO)的大小顺序是( )CO2 H2 CO H2O 甲 a mol a mol 0 mol 0 mol 乙 2a mol a mol 0 mol 0 mol 丙 0 mol 0 mol a mol a mol 丁 a mol 0 mol a mol a mol
A.丁>乙>丙=甲
B.乙>丁>甲>丙
C.乙=丁>丙=甲
D.丁>丙>乙>甲难度: 中等查看答案及解析
-
丁子香酚可做香味剂,萨罗可做消毒剂,二者的结构简式如图所示,下列说法不正确的是( )
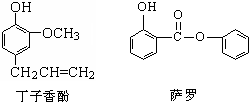
A.萨罗的分子式为C13H10O3
B.丁子香酚与浓溴水只发生取代反应
C.萨罗和丁子香酚均能发生氧化反应
D.丁子香酚和萨罗均能与氯化铁溶液发生显色反应难度: 中等查看答案及解析
-
几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )
元素代号 A B D E G H I J 化合价 -1 -2 +4、-4 -1 +5、-3 +3 +2 +1 原子半径/nm 0.071 0.074 0.077 0.099 0.110 0.143 0.160 0.186
A.A的单质能将E单质从HE3的溶液中置换出来
B.A、H、J的离子半径由大到小顺序是A>J>H
C.G元素的单质不存在同素异形体
D.I在DB2中燃烧生成两种化合物难度: 中等查看答案及解析
-
已知常温下可用Co2O3制备Cl2,反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2、H+、Cl-和Co2+.下列叙述不正确的是( )
A.氧化产物为Cl2
B.氧化剂与还原剂的物质的量之比为1:2
C.若有3molH2O生成,则反应中有2mol电子转移
D.当该反应生成2.24LCl2时,则反应中有0.1mol电子转移难度: 中等查看答案及解析
-
NaHA是二元酸H2A的酸式盐,下列说法正确的是( )
A.若NaHA的水溶液呈酸性,则二元酸H2A一定是强酸
B.若NaHA的水溶液呈碱性,则HA-只发生水解
C.无论H2A是强酸还是弱酸,NaHA溶液中Na+和HA-的个数之比都是1:1
D.无论H2A是强酸还是弱酸,NaHA晶体中的阴阳离子个数比都是1:1难度: 中等查看答案及解析

