-
《唐本草》和《本草图经》中记载:“绛矾,本来绿色,……正如瑁璃烧之赤色”“取此物(绛矾)置于铁板上,聚炭,……吹令火炽,其矾即沸,流出,色赤如融金汁者是真也”。其中不涉及的物质是( )
A.FeSO4·7H2O B.S C.Fe2O3 D.H2SO4
难度: 中等查看答案及解析
-
“84消毒液”的主要成分是NaClO。下列说法错误的是( )
A.长期与空气接触会失效
B.不能与“洁厕剂”(通常含盐酸)同时使用
C.1L0.2mol/LNaClO溶液含有0.2molClO-
D.0.1molNaClO起消毒作用时转移0.2mole-
难度: 中等查看答案及解析
-
某有机物的结构简式如图所示。下列说法错误的是( )
A.与
互为同分异构体
B.可作合成高分子化合物的原料(单体)
C.能与NaOH溶液反应
D.分子中所有碳原子不可能共面
难度: 中等查看答案及解析
-
已知:①
+HNO3
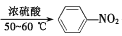 +H2O ΔH<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是( )
+H2O ΔH<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是( )A.配制混酸
 B.水浴加热
B.水浴加热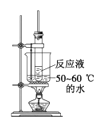
C.洗涤后分液
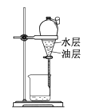 D.蒸馏提纯
D.蒸馏提纯
难度: 简单查看答案及解析
-
在两只锥形瓶中分别加入浓度均为1mol/L的盐酸和NH4Cl溶液,将温度和pH传感器与溶液相连,往瓶中同时加入过量的质量、形状均相同的镁条,实验结果如图。
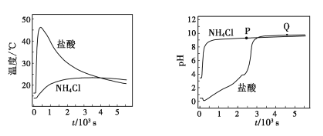
关于该实验的下列说法,正确的是( )
A.反应剧烈程度:NH4Cl>HCl
B.P点溶液:c(NH4+)+2c(Mg2+)>c(Cl-)
C.Q点溶液显碱性是因为MgCl2发生水解
D.1000s后,镁与NH4Cl溶液反应停止
难度: 中等查看答案及解析
-
我国科学家研发一种低成本的铝硫二次电池,以铝箔和多孔碳包裹的S为电极材料,离子液体为电解液。放电时,电池反应为2Al+3S=Al2S3,电极表面发生的变化如图所示。下列说法错误的是( )
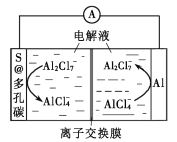
A.充电时,多孔碳电极连接电源的负极
B.充电时,阴极反应为8Al2Cl7-+6e-=2Al+14AlCl4-
C.放电时,溶液中离子的总数不变
D.放电时,正极增重0.54g,电路中通过0.06mole-
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、M的原子序数依次增大,它们组成一种团簇分子,结构如图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的
。下列说法正确的是( )
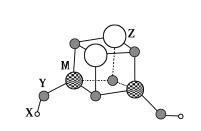
A.简单离子半径:Z>M>Y
B.常温下Z和M的单质均能溶于浓硝酸
C.X+与Y22-结合形成的化合物是离子晶体
D.Z的最高价氧化物的水化物是中强碱
难度: 简单查看答案及解析
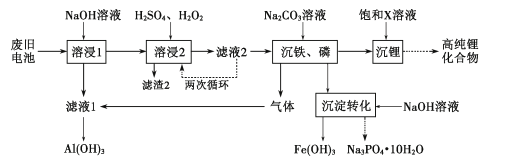
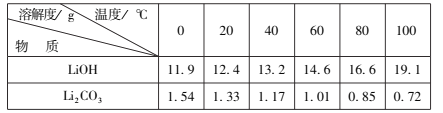
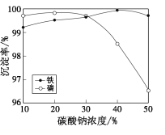

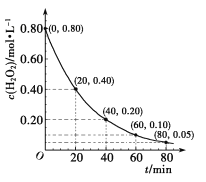
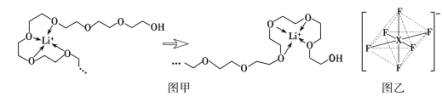
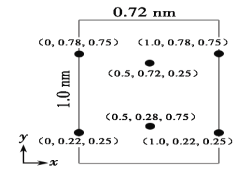
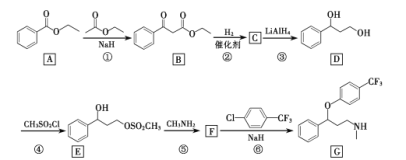
 也是一种生产氟西汀的中间体,设计以
也是一种生产氟西汀的中间体,设计以