-
化学与人类生产、生活密切相关,下列有关说法不正确的是
A.氮化硅、氧化铝陶瓷和光导纤维都是无机非金属材料
B.绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物
C.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化
D.燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施
难度: 简单查看答案及解析
-
下列关于胶体的说法正确的是
A.将可见光通过胶体出现“光路”是因为发生了光的折射
B.胶体能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
C.稀豆浆、硅酸、氯化铁溶液均为胶体
D.向沸水中逐滴加入少量饱和FeCl3溶液,继续加热搅拌可制得Fe(OH)3胶体
难度: 中等查看答案及解析
-
现有下列六个转化,其中不能通过一步反应实现的是
①SiO2→Na2SiO3 ②S→SO3 ③NH3→N2
④CuO→Cu(OH)2 ⑤Cl2→NaClO ⑥SO2→H2SO4
A.①②⑥ B.②③④ C.②④⑥ D.②④
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中,一定能大量共存的是
A.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
B.在0.1 mol·L-1Na2CO3溶液中:A13+、Na+、NO3-、C1-
C.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
D.在c(H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO3-
难度: 中等查看答案及解析
-
下列关于Li、Na、K、Rb、Cs的叙述均正确的一组是
①金属性最强的是铯
②氧化性最强的是锂原子
③在自然界中均以化合态形式存在
④它们的氧化物都只有M2O、M2O2两种形式
⑤铯与水反应十分剧烈,甚至会发生爆炸
⑥密度按Li―Cs顺序呈依次递增趋势
⑦离子半径: Rb+>K+>Na+、Cs>Cs+>K+
⑧都可以保存在煤油中
A. ①③⑤⑦ B.①④⑤⑥⑦ C.①②⑥⑧ D.①③④⑤
难度: 中等查看答案及解析
-
NA为阿伏伽德罗常数的值。下列说法正确的是
A.常温下,1 mol·L-1的NH4NO3溶液中含有氮原子的数目为2 NA
B.标况下,22.4L氯气通入足量氢氧化钠溶液中充分反应,转移的电子数为NA
C.18g D2O和18g H2O中含有的质子数均为10NA
D.将100 mL 0.1 mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
B.硫酸铁和氢氧化钡溶液反应:Fe3++SO42-+Ba2++3OH-=BaSO4↓+Fe(OH)3
C.将过量二氧化硫气体通入氨水中:SO2+NH3·H2O=HSO3-+NH4+
D.NaHSO4溶液中滴入少量Ba(OH)2 :H++SO42-+Ba2++OH-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是
A.同周期金属元素,原子失电子能力越强,最高化合价越高
B.同主族的单核阴离子,其还原性越强,氢化物的稳定性越弱
C.第二周期元素从左到右,最高正价从+1递增到+7
D.第三周期非金属元素对应的含氧酸酸性从左到右依次增强
难度: 中等查看答案及解析
-
在预防甲型H1N1流感疫情时,防疫部门使用了含氯类消毒剂,其中的氯胺是一种长效缓释有机氯消毒剂,有强氧化性,其杀菌能力是一般含氯消毒剂的4—5倍,下列有关氯胺(NH2Cl)的说法一定不正确的是
A.氯胺水解产物为NH2OH(羟氨)和HCl
B.氯胺的电子式为
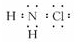
C.氯胺的消毒原理与漂白粉相似
D.氯胺中氯的化合价为+1
难度: 中等查看答案及解析
-
现有CuO和Fe2O3的混合物m克,向其中加入1 mol·L-1的HNO3溶液200 mL恰好完全反应,若将2m克该混合物用足量CO还原,充分反应后剩余固体质量为
A.(2m-1.6)克 B.2(m-1.6)克 C.(m-1.6)克 D.3.2克
难度: 中等查看答案及解析
-
下列各组物质反应产生的气体分别通入Na2SO3溶液中,与Na2SO3不发生反应的是
①Na2O2和CO2 ②Al和NaOH溶液 ③MnO2和浓盐酸共热
④浓硝酸和铜片 ⑤铜片和浓硫酸共热 ⑥碳酸钠和硫酸反应
A.只有② B.只有②⑤ C.只有②⑥ D.只有②⑤⑥
难度: 中等查看答案及解析
-
下列说法正确的是
A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
B.在用二氧化锰和浓盐酸制氯气时,在加入二氧化锰后应首先加入浓盐酸,然后再点燃酒精灯
C.在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32-
D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
难度: 中等查看答案及解析
-
已知NH4CuSO3与足量的10mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是
A.反应中硫酸作氧化剂
B.NH4CuSO3中硫元素被氧化
C.刺激性气味的气体是氨气
D.1mol NH4CuSO3完全反应转移0.5mol电子
难度: 中等查看答案及解析
-
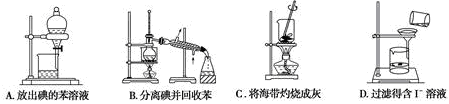
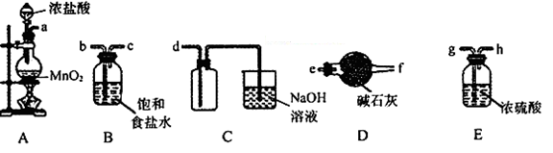
下列有关实验装置的说法中正确的是
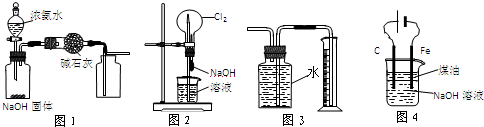
A.图1装置可制取干燥纯净的NH3
B.图2装置可以完成“喷泉”实验
C.图3装置可测量Cu与浓硝酸反应产生气体的体积
D.图4装置可用于实验室制备Fe(OH)2
难度: 中等查看答案及解析
-
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
A.至少存在5种离子
B.Clˉ一定存在,且c(Clˉ)≥0.4mol/L
C.SO42ˉ、NH4+一定存在,CO32-可能存在
D.CO32ˉ、Al3+一定不存在,K+ 一定存在
难度: 中等查看答案及解析