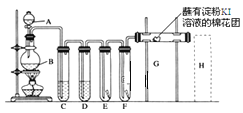
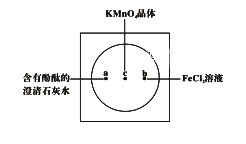
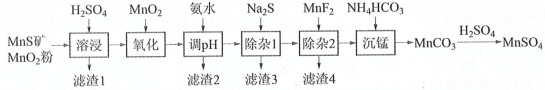
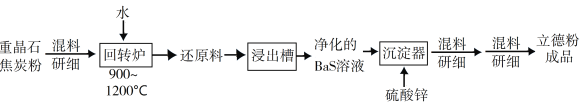
-
化学与生活密切相关。下列叙述错误的是
A. 高纯硅可用于制作光感电池
B. 铝合金大量用于高铁建设
C. 活性炭具有除异味和杀菌作用
D. 碘酒可用于皮肤外用消毒
难度: 简单查看答案及解析
-
下列有关化学反应的叙述正确的是
A. Fe在稀硝酸中发生钝化 B. MnO2和稀盐酸反应制取Cl2
C. SO2与过量氨水反应生成(NH4)2SO3 D. 室温下Na与空气中O2反应制取Na2O2
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A.NH4HCO3受热易分解,可用作化肥
B.稀硫酸具有酸性,可用于除去铁锈
C.SO2具有氧化性,可用于纸浆漂白
D.Al2O3具有两性,可用于电解冶炼铝
难度: 简单查看答案及解析
-
下列我国古代的技术应用中,不涉及氧化还原反应的是
A. 煅烧贝壳
 B. 粮食酿醋
B. 粮食酿醋
C. 古法炼铁
 D. 火药爆炸
D. 火药爆炸
难度: 简单查看答案及解析
-
化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
A.凡含有添加剂的食物对人体健康均有害,不宜食用
B.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C.人体缺乏铁元素,可以补充硫酸亚铁,且多多益善
D.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
难度: 中等查看答案及解析
-
取一小块金属钠,放在燃烧匙里加热,下列实验现象描述不正确的是( )
A. 燃烧后得白色固体 B. 燃烧时火焰为黄色
C. 燃烧后生成淡黄色固体物质 D. 金属先熔化
难度: 简单查看答案及解析
-
下列有关金属及其化合物的不合理的是( )
A. 将废铁屑加入
溶液中,可用于除去工业废气中的
B. 铝中添加适量钾,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地(含较多
等)不利于作物生长,可施加熟石灰进行改良
D. 无水
呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
难度: 中等查看答案及解析
-
下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
①氯气 ②液氯 ③新制的氯水 ④氯气的酒精溶液 ⑤盐酸 ⑥盐酸酸化的漂白粉溶液
A. ①②③ B. ①②③⑥ C. ③⑥ D. ②④⑤⑥
难度: 简单查看答案及解析
-
下列对过氧化钠的叙述中,正确的是( )
A. 过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物
B. 过氧化钠能与水反应,所以过氧化钠可以作气体的干燥剂
C. 过氧化钠与二氧化碳反应产生氧气,故可用于呼吸面具中
D. 过氧化钠与二氧化碳反应时,过氧化钠只作氧化剂
难度: 简单查看答案及解析
-
宋代著名法医学家宋慈的《洗冤集录》中有关于银针验毒的记载,“银针验毒”的原理是4Ag+2H2S+O2===2X+2H2O,下列说法不正确的是( )
A.X的化学式为Ag2S
B.银针验毒时,空气中氧气得到电子
C.反应中Ag和H2S均是还原剂
D.每生成1 mol X,反应转移2 mol e-
难度: 简单查看答案及解析
-
下列离子方程式中,正确的是 ( )
A. 稀硫酸滴在铁片上:2Fe+6H+===2Fe3++3H2↑
B. 碳酸氢钠溶液与稀盐酸混合:HCO3-+H+=H2O+CO2↑
C. 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-===Cu(OH)2↓+
D. 硝酸银溶液与氯化钠溶液混合:AgNO3+Cl-===AgCl↓+
难度: 简单查看答案及解析
-
已知在相同条件下进行下列反应:①Cl2+2KBr=2KCl+Br2;②KClO3+6HCl=3Cl2↑+KCl+3H2O;③2KBrO3+Cl2=Br2+2KClO3。下列说法正确的是 ( )
A.上述三个反应都有单质生成,所以都是置换反应
B.反应①和反应③中均生成Br2,溴元素发生的变化相同
C.反应②中被氧化与被还原物质的物质的量之比为6∶1
D.③中1 mol还原剂反应,则氧化剂得到电子的物质的量为10 mol
难度: 简单查看答案及解析
-
向Na2CO3、NaHCO3,混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
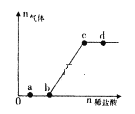
A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中:F-、NO3-、Fe2+、Ag+
难度: 中等查看答案及解析
-
下列各组离子可能大量共存的是( )
A. 在含大量Fe3+的溶液中:NH4+、Na+、Cl﹣、SCN﹣
B. 在含有Al3+、Cl﹣的溶液中:HCO3﹣、I﹣、NH4+、Mg2+
C. 在c(H+)=1×10﹣13 mol·L﹣1的溶液中:Na+、S2﹣、SO32﹣、NO3﹣
D. 在溶质为KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl﹣
难度: 简单查看答案及解析
-
下列指定反应的化学用语表达正确的是( )
A
Mg(HCO3)2溶液与足量的NaOH溶液反应
Mg2++2HCO
+4OH-===Mg(OH)2↓+2H2O+2
B
过量SO2通入到NaClO溶液中:
SO2+H2O+ClO-===HClO+
C
向Al2(SO4)3溶液中加入过量的稀氨水
Al3 ++4NH3·H2O=AlO2—+4NH4++2H2O
D
KClO碱性溶液与Fe(OH)3反应制取K2FeO4
3ClO﹣+2Fe(OH)3=2FeO42﹣+3Cl﹣+4H++H2O
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
针对下列实验现象表述不正确的是
A. 用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
难度: 困难查看答案及解析