-
硅及其化合物应用广泛,下列叙述正确的是( )
A. 硅酸钠可用于制备木材防火剂
B. 水晶项链是硅酸盐制品
C. 光导纤维的主要成分是晶体硅
D. 硅在地壳中主要以游离态形式存在
难度: 中等查看答案及解析
-
纵观古今,化学与生产、生活密切相关。下列对文献的描述内容分析错误的是( )
选项
描述
分析
A
“凡石灰,经火焚炼为用”
此“石灰”是指石灰石
B
“熬胆矾铁釜,久之亦化为铜”
该过程中发生了复分解反应
C
“以火烧之,紫青烟起,云是真硝石也”
利用焰色反应来辨别真假硝石
D
《天工开物》:凡研硝(KNO3)不以铁碾入石臼,相激火生,则祸不可测
KNO3性质不稳定,撞击易爆炸
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
将木炭磨成直径为10nm左右的炭粒后再分散到某液体分散剂中,对所得分散系的叙述正确的是( )
①一定是溶液 ②有丁达尔效应 ③能全部透过半透膜 ④可以全部透过滤纸
A.①② B.②③ C.②④ D.③④
难度: 简单查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质
实际应用
A
铁常温下遇浓硫酸钝化
用铁桶装浓硫酸
B
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
C
次氯酸盐溶液与CO2反应
漂白粉漂白织物
D
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是( )
A.熔点:X的氧化物比Y的氧化物高
B.Y的单质与Z的单质均能溶于浓硝酸
C.热稳定性:X的氢化物大于Z的氢化物
D.X与Z可形成离子化合物ZX
难度: 中等查看答案及解析
-
用NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.在同温同压时,相同体积的任何气体单质所含的原子数目相同
B.0.5molAl与足量盐酸反应转移电子数为NA
C.46gNO2和N2O4的混合物含有的分子数为NA
D.同温同体积时,两种气体的压强比等于物质的量之比
难度: 简单查看答案及解析
-
根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )

A.生成1molH2O时放出热量245kJ
B.H2O分解为H2与O2时放出热量
C.甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D.氢气和氧气的总能量小于水的能量
难度: 简单查看答案及解析
-
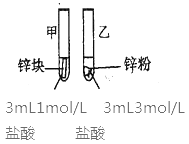
根据Zn+Cu2+=Zn2++Cu的反应原理所设计原电池装置,正确的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
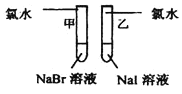
根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O=2HI+H2SO4②2FeCl3+2HI=2FeCl2+2HCl+I2
A.FeCl2>HI>H2SO3 B.HI>FeCl2>H2SO3
C.H2SO3>HI>FeCl2 D.FeCl2>H2SO3>HI
难度: 简单查看答案及解析
-
门捷列夫周期表是常见的经典形式,人们在研究前18号元素时发现,还可以将它们排成如图所示的“海螺”形状,图中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是( )
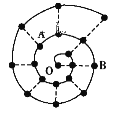
A. A、B元素的简单离子半径比较A﹥B
B. 虚线相连的元素处于同一族
C. B元素是图中金属性最强的元素
D. A、B两种元素组成的化合物中只含有离子键
难度: 中等查看答案及解析
-
五种短周期元素的某些信息如下表所示,下列有关说法正确的是( )
元素
元素的相关信息
R
最高正价与最低负价的绝对值之和等于2
W
原子的M电子层上有3个电子
X
在短周期主族元素中,其原子半径最大
Y
原子的最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成淡黄色单质
Z
最高价氧化物对应的水化物为一种强酸,可与其简单气态氢化物反应生成盐
A.W与Y、X与R形成的化合物都能与水反应,且都有气体生成
B.Z、X、W的简单离子半径依次增大
C.R与Y、Z分别形成的化合物水溶液均呈酸性
D.常温下X、Y、Z的最高价氧化物对应水化物的浓溶液都能与W的单质持续反应
难度: 中等查看答案及解析
-
下列有关SO2的性质的探究实验报告记录的实验现象正确的是( )
实验
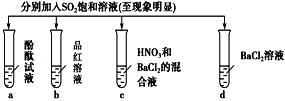
记录
A
无色
无色
无现象
无色溶液
B
红色
无色
白色沉淀
白色溶液
C
红色
红色
白色沉淀
白色溶液
D
无色
无色
白色沉淀
无色溶液
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
有关元素周期表的说法中错误的是( )
A.元素周期表中第16个纵行为ⅥA族
B.ⅦA族元素也称为卤族元素
C.0族元素的原子最外层电子数均为8,元素化合价为0
D.元素周期表中,Ⅷ族包括第8,9,10三个纵行
难度: 简单查看答案及解析
-
下列实验装置不能达到实验目的是( )
A.用SO2做喷泉实验
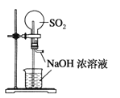
B.验证Cu与浓硝酸反应的热量变化
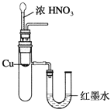
C.比较Na2CO3与NaHCO3的稳定性
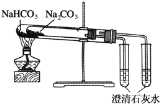
D.验证NH3易溶于水
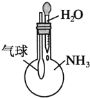
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式的是( )
A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B.钠与硫酸铜溶液反应:2Na+Cu2+=Cu+2Na+
C.过量铁与稀硝酸反应:Fe+4H++NO3-=3Fe3++2H2O+NO↑
D.等物质的量的Ba(OH)2与NaHSO4在溶液中反应:Ba2++OH−+H++SO42-=BaSO4↓+H2O
难度: 简单查看答案及解析
-
某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.1mol/L和0.4mol/L。向该混合液中加入1.92g铜粉,加热使反应发生完全。下列说法正确的是(忽略反应前后溶液体积变化)( )
A.所得溶液中c(Cu2+)=0.225mol/L
B.所得溶液中c(H+)=0.5mol/L
C.所得气体在标准状况下的体积为0.448L
D.反应中转移0.06mol的电子
难度: 中等查看答案及解析
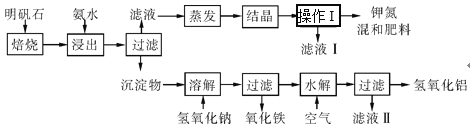
 B.过滤
B.过滤 C.蒸发
C.蒸发 D.
D.