-
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图),下列说法错误的是( )
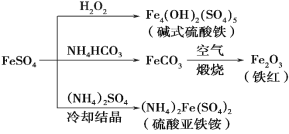
A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行,该反应的离子方程式为:Fe2++2HCO3-= FeCO3+ CO2↑+H2O
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.该温度下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,其中X是组成有机物的基本骨架元素,元素Y的核电荷数等于W原子的最外层电子数,元素Z的最高正化合价为+2价。下列说法正确的是
A.X、Y的单质均具有较高的熔沸点
B.最高价氧化物对应水化物的酸性由强到弱的顺序:W、Y、X
C.原子半径由大到小的顺序: X、Y、Z
D.Z、W形成的化合物中既含有离子键,又含有共价键
难度: 中等查看答案及解析
-
探究浓硫酸和铜的反应,下列装置或操作正确的是
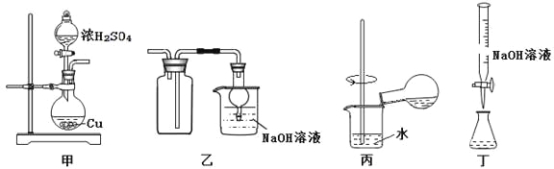
A. 用装置甲进行铜和浓硫酸的反应
B. 用装置乙收集二氧化硫并吸收尾气
C. 用装置丙稀释反应后的混合液
D. 用装置丁测定余酸的浓度
难度: 中等查看答案及解析
-
G是一种香料,结构简式如图所示:
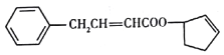 ,下列说法错误的是
,下列说法错误的是A. 常温下,G能使溴水褪色 B. G的分子式为C15H16O2
C. 苯环上二溴代物有5种 D. G分子中至少有12原子共平面
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.常温常压下,5.6L甲烷和乙烯的混合气体中含氢原子数为NA
B.7.8g Na2O2中所含阴阳离子的总数为0.3NA
C.将4.6g钠用铝箔包裹并刺小孔,与足量水充分反应生成氢气分子数为0.1NA
D.反应2KNO3+3C+S =N2↑+ 3CO2↑+K2S,每生成0.1mol N2转移电子数为NA
难度: 中等查看答案及解析
-
最近一个科学硏究小组创建了一种通过连续电解将能量储存为化学能的装置。在氧化钇基质的阳极和二氧化钛涂覆的钛阴极之间是可通过H+的固体聚合物电解质。其结构如图所示,则下列说法错误的是
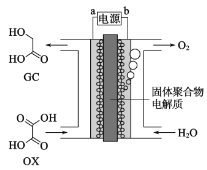
A.电源的b极为正极
B.在能量转换过程中,固体电解质中H+由阳极向阴极移动
C.阴极电极反应式为:OX+4H++4e-=GC+H2O
D.为增强阳极电解液导电性,可在水中添加适量盐酸或NaCl
难度: 中等查看答案及解析
-
下列实验方案中,可以达到实验目的的是
选项
实验目的
实验方案
A
除去苯中混有的苯酚
加入适量的溴水充分反应后过滤
B
制取Fe(OH)3胶体
向沸水中滴加FeCl3饱和溶液,继续加热至红褐色,停止加热
C
验证酸性:
CH3COOH>HClO
使用pH试纸分别测定相同温度下相同浓度的CH3COONa溶液和NaClO溶液的pH
D
检验溶液中含有I-
向某溶液中加入CCl4,振荡后静置,液体分层,下层呈紫红色
A. A B. B C. C D. D
难度: 中等查看答案及解析
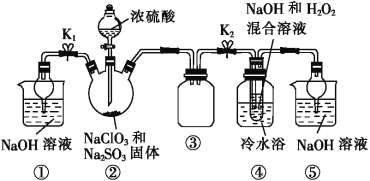
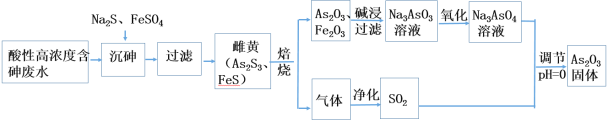
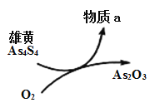
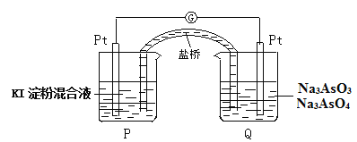
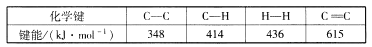
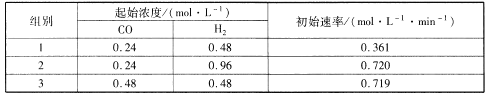
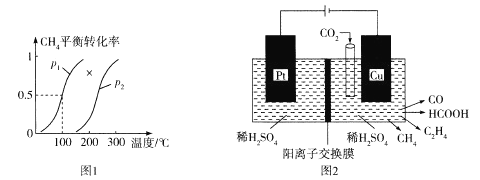
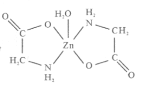 。
。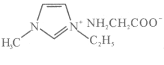 为液态而非固态,原因是________________________________________。
为液态而非固态,原因是________________________________________。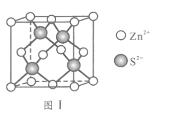
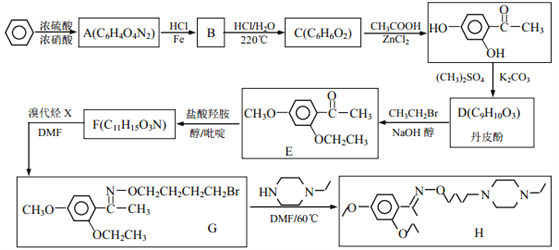
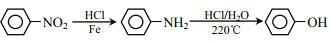
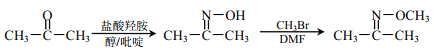
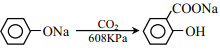
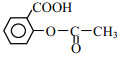 )。(用流程图表示,无机试剂任选)______。
)。(用流程图表示,无机试剂任选)______。