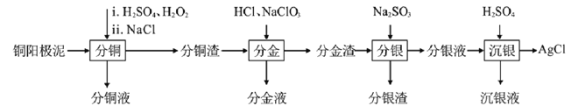
-
化学与社会、生产、生活密切相关,下列说法正确的是( )
A. 汽车尾气中的氮氧化合物是汽油或柴油不完全燃烧造成的
B. 我国全面启动的北斗导航系统的信号传输与硅有关
C. 液氯罐泄漏时,可将其移入水塘中,并向水塘中加入熟石灰
D. 工程兵开山使用的炸药“TNT”是有机高分子化合物
难度: 中等查看答案及解析
-
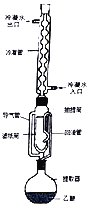
蓓萨罗丁是一种治疗顽固性皮肤T细胞淋巴瘤的药物,其结构如图所示。下列有关说法正确的是
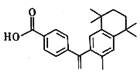
A. 分子中所有碳原子在同一平面内
B. 既能发生加成反应,又能发生消去反应
C. 能使溴水、酸性高锰酸钾溶液褪色,且原理相同
D. 1mol蓓萨罗丁分别与足量的Na、 NaHCO3反应,产生气体的物质的量之比为l︰2
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 1mol—OH含10NA个电子
B. 1molC2H518OH与足量CH3COOH充分反应可得NA个H2O
C. 标准状况下,11.2L丙烯所含的极性共价键数为3NA
D. 常温下,将1mol铁加入到足量的浓硝酸中,生成NO2气体的体积大于67.2L
难度: 中等查看答案及解析
-
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是其最内层电子数的3倍。下列说法不正确的是( )
A.原子半径:Z>W>R
B.对应的氢化物的热稳定性:R>W
C.W与X、W与Z形成的化合物的化学键类型完全相同
D.Y的最高价氧化物对应的水化物是弱酸
难度: 中等查看答案及解析
-
用下列装置进行实验能达到相应实验目的的是
A.
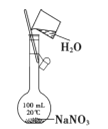 装置配制100 mL某浓度NaNO3溶液
装置配制100 mL某浓度NaNO3溶液B.
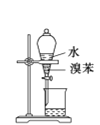 分离溴苯和水混合物
分离溴苯和水混合物C.
 验证质量守恒定律
验证质量守恒定律D.
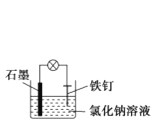 可以实现防止铁钉生锈
可以实现防止铁钉生锈难度: 中等查看答案及解析
-
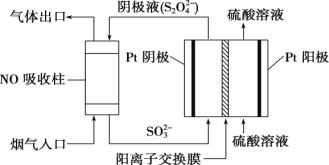
一种将CO2和H2O转换为燃料H2、CO及CH4的装置如图所示(电解质溶液为稀H2SO4)。下列关于该装置的叙述错误的是

A. 该装置可将电能转化为化学能
B. 工作时,电极a周围溶液的pH增大
C. 电极b上生成CH4的电极反应式为CO2+8H++8e-===CH4+2H2O
D. 若电极b上只产生1 mol CO,则通过质子膜的H+数为2NA
难度: 中等查看答案及解析
-
已知氧化性Br2>Fe3+>I2,向含有Fe2+、Br-、I-各0.1 mol 的溶液中通入Cl2。通入Cl2的体积(标准状况)与溶液中某种离子(用Q表示)的物质的量的关系如下图所示,下列说法中正确的是( )
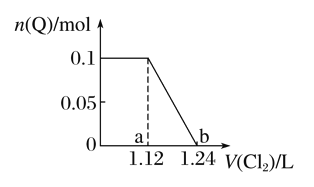
A. Q是I-
B. Q是Br-
C. b点时溶液中阴离子只有Cl-(不考虑OH-)
D. ab区间的反应:2Fe2++Cl2===2Fe3++2Cl-
难度: 困难查看答案及解析