-
分子式为C5H10O2并能与饱和NaHCO3溶液反应放出气体的有机物有(不含立体异构)( )
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
W、X、Y、Z 均为短周期元素,原子序数依次增加,W 的原子核最外层电子数是次外层的 2 倍,X-、Y+具有相同的电子层结构,Z 的阴离子不能发生水解反应。下列说法正确的是( )
A.原子半径:Y>Z>X>W
B.简单氢化物的稳定性:X>Z>W
C.最高价氧化物的水化物的酸性:W>Z
D.X 可分别与 W、Y 形成化合物,其所含的化学键类型相同
难度: 中等查看答案及解析
-
中国五年来探索太空,开发深海,建设世界第一流的高铁、桥梁、码头,5G技术联通世界等取得的举世瞩目的成就。它们与化学有着密切联系。下列说法正确的是( )
A.我国近年来大力发展核电、光电、风电、水电。电能属于一次能源
B.“神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
C.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是晶体硅
D.大飞机C919采用大量先进复合材料、铝锂合金等,铝锂合金属于金属材料
难度: 中等查看答案及解析
-
化合物如图的分子式均为C7H8。下列说法正确的是
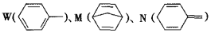
A.W、M、N均能与溴水发生加成反应 B.W、M、N的一氯代物数目相等
C.W、M、N分子中的碳原子均共面 D.W、M、N均能使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4L的H2和22.4L的F2气混合后,气体分子数为2NA
B.常温下pH=12的NaOH溶液中,水电离出的氢离子数为10−12 NA
C.30g乙酸和葡萄糖混合物中的氢原子数为2NA
D.标准状况下,2.24L C2H6含有的共价键数为0.6NA
难度: 中等查看答案及解析
-
锡为ⅣA族元素,四碘化锡是常用的有机合成试剂(SnI4,熔点144.5℃,沸点364.5℃,易水解)。实验室以过量锡箔为原料通过反应Sn+2I2
SnI4制备SnI4。下列说法错误的是
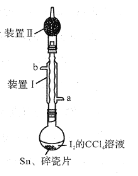
A.装置Ⅱ的主要作用是吸收挥发的I2
B.SnI4可溶于CCl4中
C.装置Ⅰ中a为冷凝水进水口
D.加入碎瓷片的目的是防止暴沸
难度: 中等查看答案及解析
-
利用如图所示装置,以NH3作氢源,可实现电化学氢化反应。下列说法错误的是
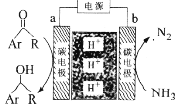
A.a为阴极
B.b电极反应为:2NH3-6e-=N2+6H+
C.电解一段时间后,装置内H+数目增多
D.理论上每消耗1 mol NH3,可生成1.5mol
难度: 中等查看答案及解析
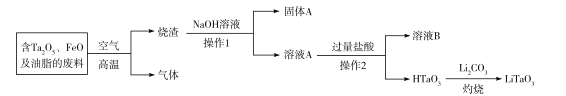
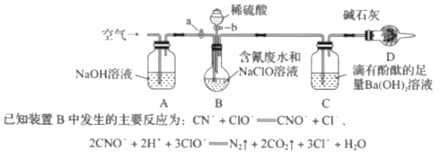

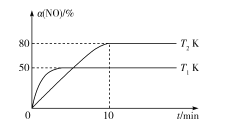
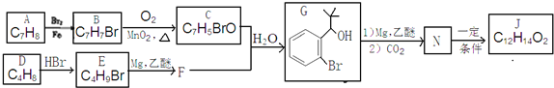
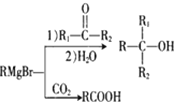
 。反应条件1为__________;反应条件2所选择的试剂为__________;L的结构简式为__________。
。反应条件1为__________;反应条件2所选择的试剂为__________;L的结构简式为__________。