-
主族元素Q、X、Y、Z、W的原子序数依次增大,且均不大于20。Q的简单氢化物和其最高价含氧酸可以化合成盐,X与Q同周期且是该周期主族元素中原子半径最小的元素;Z一具有与氩原子相同的电子层结构;Q、Y、W原子的最外层电子数之和为9。下列说法一定正确的是
A.X与Z的简单氢化物的水溶液均呈强酸性
B.Y与Z形成的化合物只含离子键
C.简单氢化物的沸点:Q<X
D.Z和W形成的化合物的水溶液呈碱性
难度: 困难查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
实验结论
A
向苯酚浊液中加入Na2CO3溶液,溶液变澄清
酸性:苯酚>HCO3-
B
将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色
Fe(NO3)2已变质
C
氯乙烷与NaOH溶液共热后,滴加AgNO3溶液,生成白色沉淀
氯乙烷发生水解
D
在2 mL 0.01 mol·L-1的Na2S溶液中先滴入几滴0.01 mol·L-1 ZnSO4溶液有白色沉淀生成,再滴入0.01 mol·L-1 CuSO4溶液,又出现黑色沉淀
Ksp(CuS)<Ksp(ZnS)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与人类生活、生产和社会可持续发展密切相关,下列有关说法正确的是
A.聚合硫酸铁[Fe2(OH)x(SO4)y]n,是新型絮凝剂,可用来杀灭水中病菌
B.家庭用的“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故
C.现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中氢原子与另一个水分子中的氧原子间形成的化学键
D.中国天眼 FAST 用到的高性能碳化硅是一种新型的有机高分子材料
难度: 简单查看答案及解析
-
设 NA 为阿伏加德罗常数的值。下列有关叙述正确的是
A.在 12.0g NaHSO4 晶体中,所含离子数目为 0.3NA
B.足量的镁与浓硫酸充分反应,放出 2.24L 混合气体时,转移电子数为 0.2NA
C.30g 冰醋酸和葡萄糖的混合物中含氢原子的数目为 2NA
D.标准状况下,11.2L 乙烯和丙烯混合物中含氢原子数目为 2NA
难度: 简单查看答案及解析
-
维生素C是广泛存在于新鲜水果蔬菜及许多生物中的一种重要的维生素,作为一种高活性物质,它参与许多新陈代谢过程。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
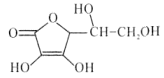 +I2
+I2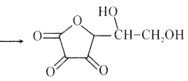 +2HI
+2HI下列说法正确的是( )
A.上述反应说明维生素C能使碘水褪色,该反应的反应类型为取代反应
B.维生素C可发生取代反应、加成反应、氧化反应
C.维生素C可以水解得到2种产物
D.维生素C不可溶于水,可以溶于有机溶剂
难度: 简单查看答案及解析
-
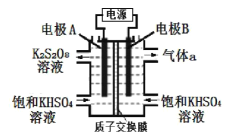
中国第二化工设计院提出,用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图,下列相关判断正确的是
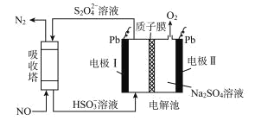
A.电极 I为阴极,电极反应式为 2H2O+2e-=2OH-+H2↑
B.电解池中质子从电极 I 向电极Ⅱ作定向移动
C.每处理 1 mol NO 电解池右侧质量减少 16 g
D.吸收塔中的反应为 2NO+2S2O42-+H2O=N2+4HSO3-
难度: 中等查看答案及解析
-
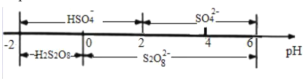
亚磷酸(H3PO3)是二元弱酸,主要用于农药中间体以及有机磷水处理药剂的原料。常温下,向1L0.500mol·L-1H3PO3溶液中滴加等浓度的NaOH溶液,混合溶液中含磷粒子的物质的量分数(δ)与溶液pH的关系如图所示,下列说法正确的是
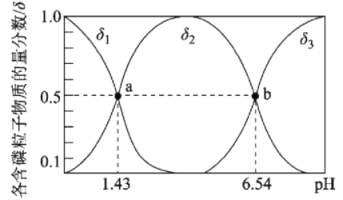
A.a、b两点时,水电离出的c水(OH-)之比为1.43:6.54
B.b点对应溶液中存在:c(Na+)=3c(HPO32-)
C.反应H3PO3+HPO32-
2H2PO3-的平衡常数为105.11
D.当V(NaOH)=1 L 时,c(Na+)>c(H2PO3-)>c(OH-)>c(H+)
难度: 中等查看答案及解析

 ②
② ③
③


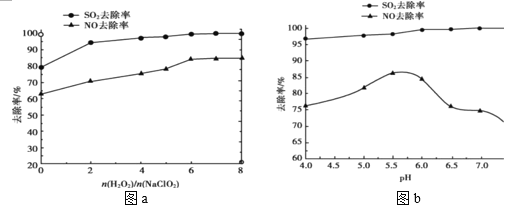
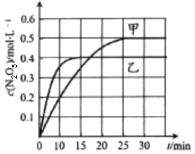
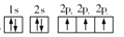 B.
B.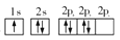
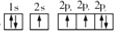 D.
D.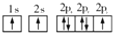
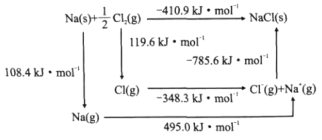

 B.
B. C.
C. D.
D.