-
下列实验过程可以达到实验目的的是
编号
实验目的
实验过程
A
配制0.4000 mol·L−1的NaOH溶液
称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立即转移至250 mL容量瓶中定容
B
探究维生素C的还原性
向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
C
制取纯净氢气
向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液
D
探究浓度对反应速率的影响
向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5%H2O2溶液,观察实验现象
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
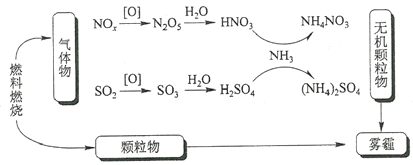
A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.常温常压下,1.6 g O2与O3的混合物中含有的氧原子数为0.1NA
B.标准状况下,3.36 L CHCl3含有的共价键数目为0.6NA
C.0.1 mol O2与0.2 mol SO2混合,转移的电子数为0.4NA
D.1.8 g D2O中含有的中子数为NA
难度: 中等查看答案及解析
-
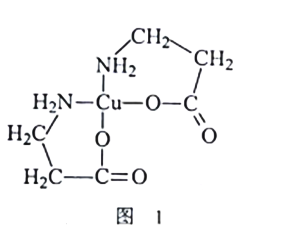
某有机物的结构简式如图所示,下列说法错误的是
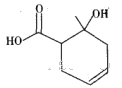
A.与乙酸互为同系物
B.含有两种含氧官能团
C.可使溴的四氯化碳溶液褪色
D.既可以发生取代反应又可以发生加成反应
难度: 中等查看答案及解析
-
短周期元素A、B、C、D最高价氧化物对应水化物分别为X、Y、Z、W,A是短周期中原子半径最大的元素,常温下X、Z、W均可与Y反应,A、C、D的原子序数及0.1mol/L X、Z、W溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
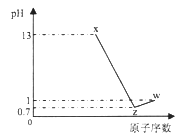
A. A的离子半径小于B的离子半径
B. W、X两物质含有的化学键类型相同
C. D氢化物稳定性小于C氢化物稳定性
D. B的简单离子会影响水的电离平衡
难度: 中等查看答案及解析
-
镁—次氯酸盐燃料电池的工作原理如右图所示,该电池反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-
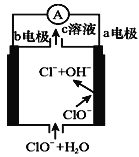
下列有关说法正确的是( )
A.电池工作时,c溶液中的溶质一定是MgCl2
B.负极反应式:ClO--2e-+H2O=Cl-+2OH-
C.电池工作时,OH-向b电极移动
D.b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl-
难度: 中等查看答案及解析
-
常温下,几种难溶金属氢氧化物分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图所示。下列说法正确的是

A.a点代表Fe(OH)3的饱和溶液
B.Ksp[Cu(OH)2]<Ksp[Fe(OH)2]
C.向0.1 mol·L-1Cu2+、Mg2+、Fe2+混合溶液中,逐滴滴加稀NaOH溶液,Mg2+最先沉淀
D.在pH=7的溶液中,Cu2+、Mg2+、Fe2+能大量共存
难度: 困难查看答案及解析
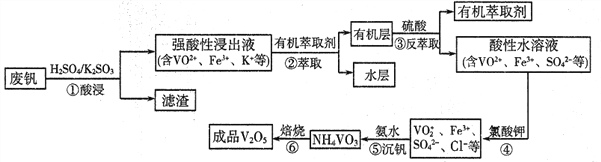

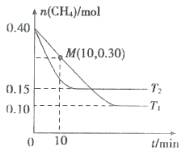
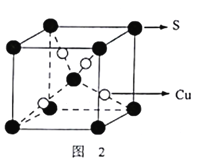 。
。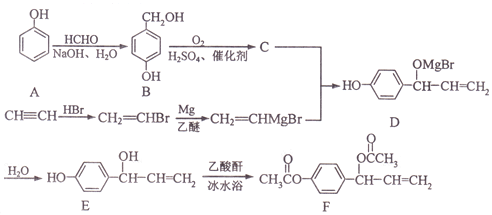
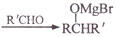
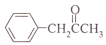 , 写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________
, 写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________