-
化学与生活、环境密切相关,下列说法错误的是
A. 做油条用的膨松剂不应含明矾
B. 享有“镇国之宝”称谓的“后母戊鼎”属于青铜制品
C. 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
D. “煤改气”可以减少SO2等有害物质的排放量,有利于“雾霾”天气的治理
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 油脂进入体内后可直接被吸收、利用
B. 葡萄糖、蔗糖有甜味,故糖类物质均有甜昧
C. 乙醇、乙酸均可与钠反应,用钠无法鉴别两者
D. 甲烷、三氯甲烷在光照条件下均可与Cl2发生取代反应
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1L0.5mol·L-1葡萄糖溶液中O-H键数目为2.5NA
B. 5.6g铁与硝酸完全反应时转移的电子数目可能为0.25NA
C. 0.lmol苯与足量氢气反应后,破坏碳碳双键的数目为0.3NA
D. 10 g KHCO3和CaCO3的固体混合物中含有的CO32-数目为0.1NA
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的四种短周期主族元素,由X、Y形成的一种常见的气态化合物不能稳定地存在于空气中,Z、W同周期且W的最高正价是Z的7倍。下列有关说法正确的是
A. 单质沸点:W<Y
B. 简单离子半径:W>X>Y>Z
C. 含氧酸的酸性:W>X
D. Z与Y形成的化合物中只含离子键
难度: 中等查看答案及解析
-
某种可用于治疗心脏病的药物X的结构简式为
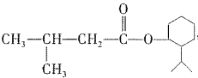 ,下列有关X的说法错误的是
,下列有关X的说法错误的是A. X可能有香味,是乙酸乙酯的同系物
B. X不溶于水,密度可能比水的小
C. 遇碱溶液或酸溶液均易变质
D.
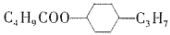 与X互为同分异构体
与X互为同分异构体难度: 中等查看答案及解析
-
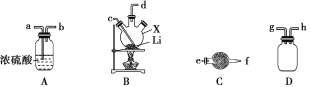
某同学欲利用如图装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。下列分析正确的是
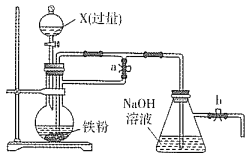
A. X可以是稀硫酸或稀硝酸或稀盐酸
B. 实验开始时应先关闭止水夹a、打开b,再向烧瓶中加入X
C. 反应一段时间后可在烧瓶中观察到白色沉淀
D. 反应结束后若关闭b及分液漏斗活塞,则Fe(OH)2可较长时间存在
难度: 中等查看答案及解析
-
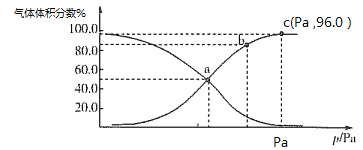
常温下,用0.10mol·L-1的NaOH溶液滴定20.00mL浓度为0.10mol·L-1的HX溶液所得滴定曲线如下图(忽略溶液体积变化)。下列说法正确的是

A.常温下K(HX)≈1×10-12
B.a点所示的溶液中:c(Na+)>c(X-)>c(OH-)=c(H+)
C.c点所示的溶液中:c(Na+)+c(HX)+c(X-)=0.10mol·L-1
D.相同条件下,X-的水解能力弱于HX的电离能力
难度: 中等查看答案及解析
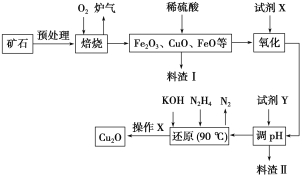
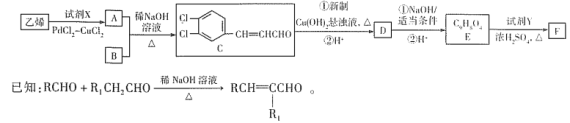
 )在自身免疫性疾病的治疗中有着重要的应用,工业上以乙烯和芳香族化合物B为基本原料制备F的路线图如下:
)在自身免疫性疾病的治疗中有着重要的应用,工业上以乙烯和芳香族化合物B为基本原料制备F的路线图如下: