-
十九大报告指出:建设生态文明是中华民族永续发展的千年大计。必须树立和践行绿水青山就是金山银山的理念.....,实行最严格的生态环境保护制度,形成绿色发展方式和生活方式。则下列说法不正确的是
A. PM2.5是指粒径不大于2.5µm的可吸入悬浮颗粒物
B. 以液化石油气代替燃油可减少大气污染
C. 生活污水可灌溉庄稼,所以能排放到自然界水体中
D. 创新生产工艺,实现电动机车替代燃油机车符合绿色发展方式
难度: 中等查看答案及解析
-
X、Y、Z、W是短周期主族元素,且原子序数依次增大,X元素的周期序数等于其主族序数,且X为同主族元素中唯一非金属元素,Y元素的单质是一种强力漂白剂,Z元素形成的简单离子是同周期半径最小的离子,含元素W的一种化合物是木材防火剂的原料,下列叙述错误的是( )
A. 上述四种元素的原子半径大小:Z>W>Y>X
B. Z的氢氧化物和NaHCO3均可中和过多的胃酸,治疗胃溃疡
C. X与Y可形成既含极性共价键又含非极性共价键的共价化合物
D. W与Y形成的化合物既是建筑材料,也是工艺品(玛瑙等)的原料
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2 L
B. 7.8gNa2S和Na2O2的混合物中含有的阴离子数等于0.1NA
C. 25℃,1.01×105 Pa,22.4LSO2中含有的原子数为3NA
D. 标准状况下,11.2L乙醇含有的分子数为0.5NA
难度: 中等查看答案及解析
-
为了除尽NaCl中所含杂质MgCl2、CaCl2和Na2SO4,先后向溶液中加入稍过量的NaOH、BaCl2和NaCO3,去除沉淀后再用盐酸调节pH=7。下列加入该三种试剂的先后顺序错误的是
A. NaOH、BaCl2、 Na2CO3 B. BaCl2、Na2CO3、 NaOH
C. NaOH、Na2CO3、BaCl2 D. BaCl2、NaOH、Na2CO3
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 聚乙烯不能使酸性KMnO4溶液褪色
B.
和
均是芳香烃,
既是芳香烃又是芳香化合物
C.
和
分子组成相差一个—CH2—,因此是同系物关系
D. 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH
难度: 中等查看答案及解析
-
NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图,该电池在使用中石墨I电极上生成氧化物Y,下列说法错误的是
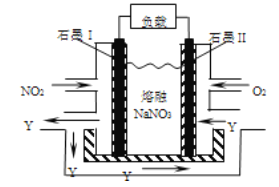
A. Y的化学式可能为NO
B. 石墨I极为负极,石墨Ⅱ极为正极
C. 该电池放电时NO3-从右侧向左侧迁移
D. 石墨I附近发生的反应为NO2+NO3ˉ-eˉ=N2O5
难度: 中等查看答案及解析
-
常温下,取0.1mol/L的NaA和NaB 两种盐溶液各1L,分别通入0.02mol CO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。HA和HB 的1L 溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是
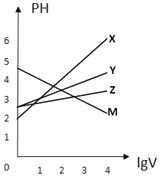
A. 相同条件下,对于c(R-)/[c(HR)·c(OH-)]的值(R代表A或B),一定存在HA>HB
B. 常温下pH: NaA 溶液>NaB 溶液
C. X是HA,M是HB
D. 若常温下浓度均为0.1mol/L 的NaA和HA 的溶液等体积混合,则c(A-)+c(HA)=0.2mol/L
难度: 中等查看答案及解析

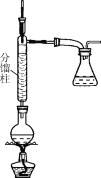
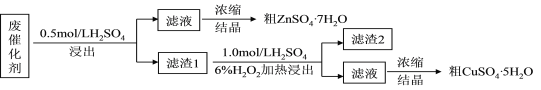
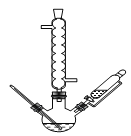 B.
B.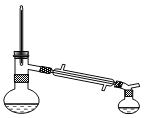
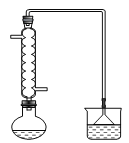
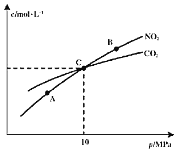
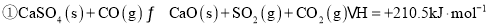
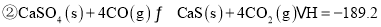
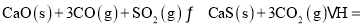 ______
______