-
下列分子中的中心原子杂化轨道的类型相同的是( )
A.CO2与H2O B.CH4与NH3 C.BeCl2与BF3 D.C2H2与C2H4
难度: 中等查看答案及解析
-
据报道,在40GPa高压下,用激光器加热到1800K,科学家已成功合成出CO2原子晶体,下列有关这种CO2晶体推断正确的是
A.易液化,可用作制冷材料
B.CO2晶体中,每个C原子周围结合2个O原子,每个O原子跟1个C原子结合
C.硬度很大,可用作耐磨材料
D.在一定条件下,CO2分子晶体转化为原子晶体是物理变化
难度: 中等查看答案及解析
-
常温下,有关水溶液pH的下列说法中正确的是
A.在pH=12的溶液中,水电离出的c(OH-)=10-2mol·L-1
B.将pH=2和pH=12的酸、碱溶液等体积混合后,溶液的pH=7
C.若强酸、强碱中和后pH=7,则中和之前pH酸+pH碱=14
D.含等物质的量的HNO3、Na2CO3、CH3COOH的溶液混合后,溶液的pH>7
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、Q的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z的核电荷数比Y多5,W与Y同主族。下列说法正确的是( )
A.简单离子半径的大小顺序:W>Q>Z>Y
B.X、W、Q最高价氧化物对应的水化物均可与Z的最高价氧化物对应的水化物反应
C.QY2可用于自来水的杀菌消毒
D.X的氢化物沸点一定低于Y的氢化物沸点
难度: 中等查看答案及解析
-
化学与生活密切相关,下列说法正确的是
A.铝制容器不宜长时间存放酸性食物、碱性食物以及含盐腌制食物
B.生活中常用热的小苏打除油污,利用的是水解反应吸热的特点
C.
可通过电解
的水溶液来制取,
可通过电解熔融的
来制取
D.用浓硫酸刻蚀石英材料制作艺术品
难度: 中等查看答案及解析
-
国际计量大会第26次会议新修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),并于2019年5月20日正式生效。下列说法正确的是( )
A.在Al3+数目为NA的AlCl3溶液中,Cl-总数为3 NA
B.常温下,42g乙烯和丙烯的混合物中所含H原子的数目是6 NA
C.4molNH3与6molO2在催化剂和加热条件下充分反应,所得产物中NO的分子数是4 NA
D.常温常压下,2g羟基(
)中所含的中子数为NA
难度: 中等查看答案及解析
-
是一种杀菌效率高、二次污染小的水处理剂。实验室可通过反应制得
:
。下列说法正确的是
A.氧化产物为
B.
在反应中失去电子
C.氧化剂与还原剂的物质的量之比为1∶2 D.1mol
参加反应有2mol电子转移
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
实验结论
A
向0.1mol/L碳酸钠溶液中滴入酚酞,溶液变红,加热,红色加深。
碳酸钠属于弱碱
B
测定醋酸溶液pH,用玻璃棒蘸取溶液,点在pH试纸上,试纸显红色。
醋酸溶液显酸性
C
将铜片和锌片用导线相连,插入CuSO4溶液中,锌片质量减小,铜片质量增加。
锌被还原
D
向氯化银的浊液中滴入KI溶液,浊液中的固体由白色变为黄色。
Ksp(AgCl)<Ksp(AgI)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)= CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+
O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( ).
A.-488.3 kJ/mol B.-244.15 kJ/mol C.488.3 kJ/mol D.244.15 kJ/mol
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是( )
A.对于2HI(g)
H2(g)+ I2(g),达平衡后,缩小容器体积可使体系颜色变深
B.合成氨反应中为提高氨的产率,理论上应采取降低温度的措施
C.实验室配制FeCl3溶液时,将FeCl3固体加入到少量的浓盐酸中再加水稀释
D.用饱和食盐水可以去除Cl2中的HCl
难度: 中等查看答案及解析
-
下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
难度: 中等查看答案及解析
-
下列有关说法中,错误的是( )
A.NH4H是一种离子晶体,其中氢离子的核外电子排布与氦原子相同
B.在石墨晶体中,碳原子与共价键的个数比为2:3
C.三种氢化物的沸点高低:HBr>HCl>HF
D.甲基的电子式为
难度: 中等查看答案及解析
-
有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为
A.
B.
C.
D.
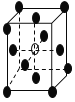
难度: 中等查看答案及解析
-
1,2,4—三甲苯
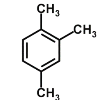
是无色透明液体,不溶于水,溶于乙醇、乙醚、苯等。下列有关1,2,
三甲苯的说法正确的是
A.分子中所有碳原子不可能处于同一平面上
B.苯环上的一氯代物只有2种
C.分子式为
D.与异丙苯
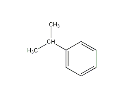
属于同分异构体
难度: 中等查看答案及解析
-
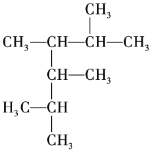
烷烃
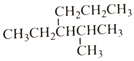 的命名正确的是
的命名正确的是A.4-甲基-3-丙基戊烷 B.3-异丙基己烷
C.2-甲基-3-丙基戊烷 D.2-甲基-3-乙基己烷
难度: 中等查看答案及解析
-
正确掌握化学用语和化学基本要领是学好化学的基础。下列有关表述中正确的一组是( )
A.过氧乙酸(CH3COOOH)与烃基乙酸(HOCH2COOH)所含官能团相同,互为同分异构体
B.16O与18O互为同位素:H216O、D216O、H218O、D218O互为同素异形体
C.SiH4、CH4、P4分子的空间构型为正四面体形;CO2、C2H2均为直线形分子
D.Ca2+的结构示意图为
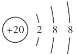 ;NH4Cl的电子式为
;NH4Cl的电子式为难度: 中等查看答案及解析
 的名称为______。
的名称为______。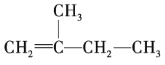 的名称为______。
的名称为______。