-
硒和碲在工业上有重要用途。在铜、镍镇、铅等电解工艺的阳极泥中硒、碲确主要以硒化物、碲化物及单质状态存在。一种从阳极泥中提取Se和Te的工艺流程如下:
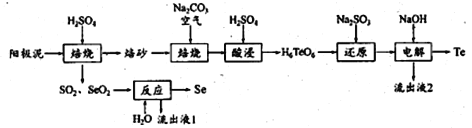
已知:碲酸四氢钠(Na2H4TeO6)难溶,碲酸(H6TeO6)可溶。回答下列问题:
(1)阳极泥在600K左右加入一定浓度H2SO4焙烧时,,单质Te转化为TeO2 的化学方程式为_______________。
(2)“焙砂”与碳酸钠充分混合,干燥后通入空气焙烧,发生氧化反应,每生成1mol碲酸四氢钠(Na2H4TeO6),则需要的氧化剂O2至少为______mol;生成的碲酸四氢钠不用“水浸”,而采取“酸浸”的原因是____________。
(3)流程中“反应”处发生反应的化学方程式为________________________________。
(4)检验“还原”后的溶液中Na2SO3是否过量的实验操作方法为___________________________________。
(5)工艺路线中可以循环利用的物质有_________、____________________。
-
碳元素与人们的日常生活、生活和科学研究密不可分。请回答下列问题。
(1)乙烯具有水果催熟的功效,乙烯的电子式是______________。
(2)Al2O3真空碳热还原一氯化法是一种新的炼铝工艺,该法流程短,设备简单,符合目前国家提倡节能减排、改造升级的大环境。
①其中冶炼过程中发生的反应有:
(ⅰ)2Al2O3(s)+9C(s)=Al4C3(s)+6CO(g) △H1;
(ⅱ)Al2O3(s)+Al4C3(s)+3AlCl3(g)=9AlCl(g)+3CO(g) △H2;
(ⅲ)3AlCl(g)=AlCl3(g)+2Al(l) △H3;
则Al2O3(s)+3C(s)= 2Al(l)+ 3CO(g) △H4=___________________(用含△H1、△H2、△H3的代数式表示)。
②Al4C3是真空碳热还原一氯化法炼铝的中间产物,该物质与水反应生成最简单的有机物。该反应的化学方程式为__________________________________。
(3)利用活性炭的还原性可处理机动车的尾气(氮氧化物),发生如下反应C(s)+2NO(g) N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度与时间的变化如下表所示:
N2(g)+CO2(g) △H>0,一定条件下,密闭容器中的有关物质的浓度与时间的变化如下表所示:
| 时间/mim 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 | 0.6 |
| N2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
| CO2 | 0 | 0.42 | a | b | 1.2 | 1.2 |
①0~20 min内的平均反应速率v(CO2)=_______mol·L-1·min-1;第一次达到平衡的平衡常数K=__________。
②30 min时只改变某一条件,则改变的条件可能是______________ (填字母编号)。
a.升高温度 b.降低温度 c.再通入一定量的NO
d.缩小容器的体积 e.加入合适的催化剂 f.增大容器休积
(4)炼钢炉中发生复杂的化学反应,其中包括反应:C(s)+CO2(g) 2CO(g) △H>0。将1molCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。达到平衡时,容器内气体体积分数与温度的关系如下图:
2CO(g) △H>0。将1molCO2与足量的碳充入到一个恒压密闭容器中,总压强为P总。达到平衡时,容器内气体体积分数与温度的关系如下图:
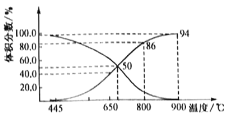
①CO2体积分数为86%时,CO2的转化率为______________%(结果保留一位小数,下同)。
②已知:气体分压P分=P总×气体体积分数,达到平衡时用气体的分压代替气体浓度所表示的平衡常数为Kp,则900℃时,Kp=______________(用含p总的代数式表示)。
-
聚氮化硫(SN)x和K3C60是两种不同类型的超导材料。回答下列问题:
(1)在基态K原子中,能量最低的空轨道的符号是_____________。
(2)S、N、K三种元素的第一电离能由大到小的顺序是____________。
(3)(SN)x具有类似黄铜的金属光泽和导电性,其结构如下图:
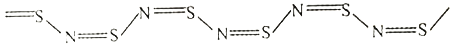
以S2Cl2为原料可制取(SN)x:S2Cl2→…S4N4  S2N2
S2N2  (SN)x
(SN)x
①(SN)x中N 原子的杂化方式是 _________; (SN)x的晶体类型是______;
②S2Cl2的结构式为________;
③Ag元素位于周期表第5周期、IB族,基态Ag原子的价电子排布式为__________。
(4)K3C60是由足球烯(C60) 与金属钾反应生成的盐。
①在K3C60晶胞中,C603-堆积方式为面心立方结构,每个晶胞中形成4 个八面体空隙和8个四面体空隙,K+填充在空隙中。晶胞中被K+占据的空隙百分比为___________。
②C60与金刚石互为同素异形体,比较两者的熔沸点并说明理由____________。
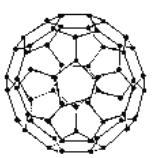
③C60的结构是一种多面体,如图。多面体的顶点数、面数和棱边数的关系遵循欧拉定律:顶点数+面数-棱边数=2。C60分子中所含的五边形和六边形的个数分别为_____、______。
-
左乙拉西坦(物质G)是一种治疗癫痫的药物,可通过以下方法合成:
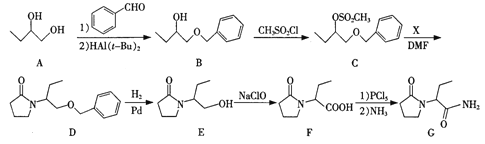
(1)B中的含氧官能团名称为_______。
(2)E→F的反应类型为_________。
(3)X的分子式为C4H7ON,写出X的结构简式:____________。
(4)写出同时满足下列条件的G的一种同分异构体的结构简式:________。
① 能发生水解反应,水解产物仅有一种,且为α-氨基酸;
② 分子中含六元环结构,且有4种不同化学环境的氢。
(5)请以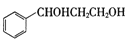 和
和 为原料制备
为原料制备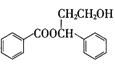 ,写出相应的合成路线流程图________ [合成须使用试剂HAl(t-Bu)2,无机试剂任用,合成路线流程图示例见本题题干]。
,写出相应的合成路线流程图________ [合成须使用试剂HAl(t-Bu)2,无机试剂任用,合成路线流程图示例见本题题干]。
为阿伏伽德罗常数,下列说法正确的是( )
(羟基)与
中所含的电子数均为
;
苯与足量的
反应时,参与反应的碳碳双键数为
被
溶液氧化放出
分子数为
乙烯和丙烯的混合气体中含有的氢原子数为
 判断下列说法中不正确的是
判断下列说法中不正确的是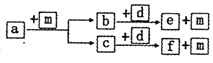

的变化关系



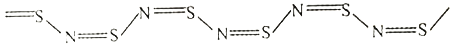


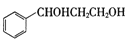 和
和 ,写出相应的合成路线流程图________ [合成须使用试剂HAl(t-Bu)2,无机试剂任用,合成路线流程图示例见本题题干]。
,写出相应的合成路线流程图________ [合成须使用试剂HAl(t-Bu)2,无机试剂任用,合成路线流程图示例见本题题干]。