-
中秋节是我国的传统节日之一。下列关于中秋月饼的说法正确的是( )
A.月饼中的脱氢乙酸钠是一种防腐保鲜剂,含量越高,月饼的质量越好
B.月饼中的柠檬酸属于改善口味的一种酸味剂,柠檬酸是一种强酸
C.月饼加工过程中的“膨松剂”可用小苏打,小苏打属于碱类
D.月饼包装袋内有一小袋的“脱氧剂”,其主要成分是还原铁粉
难度: 简单查看答案及解析
-
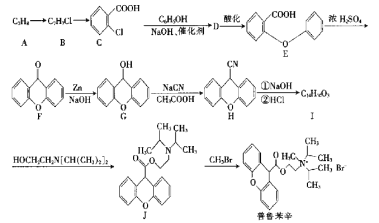
下列关于图示有机物的说法正确的是( )
A.属于芳香烃,且能发生加成反应
B.—氯代物有四种(不考虑立体异构)
C.其同分异构体可与苯互为同系物
D.所有原子处于同一平面
难度: 简单查看答案及解析
-
设
为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,
一氧化氮和
氧气混合后的分子总数小于
B.常温下,
固体含有的分子总数为
C.
时,
的
,则饱和
溶液中
的数目为
D.
时,
的
溶液中含有的
数目为
难度: 中等查看答案及解析
-
下列依据所给条件推出的结论不正确的是( )
选项
条件
结论
A
在水溶液中或熔融状态下可以导电的化合物称为电解质
CH3COOH水溶液中存在:CH3COOH
CH3COO-+H+,因此CH3COOH是电解质
B
凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱
H2O既是酸又是碱
C
Fe3Cl8可以改写为FeCl2·2FeC13
Fe3I8可以改写为FeI·2FeI3
D
HCl在一定条件下能被MnO2氧化为Cl2
HBr在一定条件下也能被MnO2氧化为Br2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
用电解法处理硼酸铵料液(主要成分为分离出铵盐及硼酸的装置如图所示。装置工作时,下列说法错误的是( )
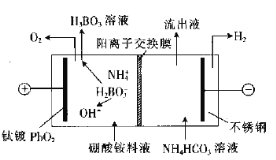
已知:NH4H2BO3易溶于水,硼酸为弱酸。
A.从阳极室迁移至阴极室的主要离子是H+
B.阳极室电极周围溶液的pH不断减小
C.阴极室流出液中含NH4HCO3和(NH4)2CO3
D.阳极区溶液中发生的反应之一为H2BO3-+H2O=H3BO3+OH-
难度: 中等查看答案及解析
-
化合物甲(如图所示)中所有原子都达到了 8电子稳定结构,X、Y、Z、W是原子序数依次增大的短周期主族元素,原子半径:r(w)> r(X)> r(Y) > r(Z)。下列说法正确的是( )

A.YZ,属于酸性氧化物
B.元素的非金属件强弱:Y>Z
C.X的最高价氢化物对应的水化物是强酸
D.Y的最简单氢化物能与W的氢化物反应
难度: 中等查看答案及解析
-
已知:
,
。
时,向
溶液中滴加氢氧化钠溶液,混合溶液的pOH与
的变化关系如图所示。下列叙述正确的是
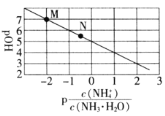
A.M点溶液中:
B.
的数量级为
C.M点到N点:
的值不变
D.N点:
难度: 中等查看答案及解析
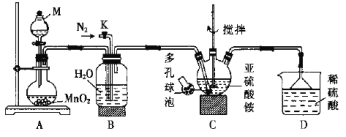
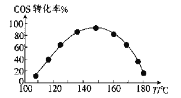
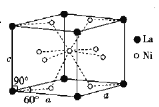
 ,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_____(保留整数)。
,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_____(保留整数)。