-
方程式中正确的是
A.向碳酸氢钙溶液中加入过量氢氧化钠
:Ca2++2HCO
+2OH-
CaCO3↓+CO
+2H2O
B.氧化铁可溶于氢碘酸:Fe2O3+6H+
2Fe3++3H2O
C.Fe3+的检验:Fe3++3SCN-
Fe(SCN)3↓
D.(NH4)2Fe(SO4)2溶液与过量的NaOH溶液反应:Fe2++2OH-
Fe(OH)2↓
难度: 中等查看答案及解析
-
将1mol NaHCO3和1mol Na2O2固体混合,在加热的条件理使其充分反应,则最后所得固体为
A.1mol Na2CO3和1mol NaOH B.lmol Na2CO3和2molNaOH
C.2mol Na2CO3和2molNaOH D.2mol Na2CO3
难度: 中等查看答案及解析
-
下列各组物质中,气体X和气体Y在通常条件下同时通入盛有溶液Z的洗气瓶中(如图所示),一定没有沉淀生成的是(已知常温下NaHCO3的溶解度小于Na2CO3、NaCl、NH4Cl、(NH4)2CO3和NH4HCO3的溶解度)

难度: 中等查看答案及解析
-
已知①2C(s)+O2(g)=2CO(g);ΔH=-221.0kJ/mol ②2H2(g)+O2(g)=2H2O(g);
ΔH =-483.6kJ/mol。则制备水煤气的反应C(s)+H2O(g)=CO(g)+H2(g);ΔH为
A.+262.6kJ/mo1 B.-131.3kJ/mol
C.-352.3kJ/mol D.+131.3kJ/mol
难度: 中等查看答案及解析
-
下列各项中的两个量,其比值一定为2:1的是
A.液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体
B.在碳与浓硫酸的反应中,还原产物与氧化产物的物质的量
C.1mol Na2O2与1molNa2O中的阴离子数目
D.相同温度下,0.2mol/L醋酸溶液和0.1mol/L醋酸溶液中c(H+)
难度: 中等查看答案及解析
-
已知2Fe3++2Br-=2Fe2++ Br2,当把Cl2通入FeBr 2溶液中时,下列离子方程式一定不正确的是
A.Cl2+2Br-= Br2+2Cl-
B.4Cl2+6Br-+2Fe2+=2Fe3++3Br2+8Cl-
C.3Cl2+2Fe2++4Br-=2Fe3++2Br2 +6Cl-
D.2Cl2+2Fe2++2Br-=2Fe3++Br2+4Cl-
难度: 中等查看答案及解析
-
有平衡体系:CO(气) + 2H2(气)
CH3OH(气) ;ΔH<0为了增加甲醇的产量,工厂应采取正确的措施是
A、高温、高压 B、适宜的温度、高压、催化剂
C、低温、低压 D、低温、低压、催化剂
难度: 中等查看答案及解析
-
根据相关化学知识分析,下列推断正确的是
A.若X原子中的质子数为a,中子数为b,则X的质量数为:a-b
B.若弱酸HA的酸性强于弱酸HB,则同物质的量浓度钠盐溶液的碱性比较为:NaA<NaB
C.若R2-和M+的电子层结构相同,则原子序数的比较为:R>M
D.若反应A2+2D—==2A-+D2能发生,则氧化性的比较为:D2>A2
难度: 中等查看答案及解析
-
一定温度下,1molX和n mol Y在容积为2L的密闭容器中发生如下反应:
X(g)+Y(g)
Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
A.向平衡后的体系中加入1mol M,平衡向逆反应方向移动
B.用X表示此反应的反应速率是(0.1—0.1a)mol·(L·min)—1
C.向上述平衡体系中再充入1molX,v(正)增大,v(逆)减小,平衡正向移动
D.当混合气体的质量不再发生变化时,说明反应达到平衡状态
难度: 中等查看答案及解析
-
在密闭容器中进行如下反应:X2(气) + Y2(气)
2Z(气), 已知 X2、Y2、Z的起始浓度分别为 0.1 mol/L, 0.3 mol/L, 0.2 mol/L, 在一定的条件下, 当反应达到平衡时, 各物质的浓度不可能的是
A.Z 为 0.3 mol/L B.Y2 为 0.35 mol/L
C.X2 为 0.12 mol/L D.Z 为 0.4 mol/L
难度: 中等查看答案及解析
-
已知常温下的醋酸铵溶液呈中性,下列叙述正确的是
A.醋酸铵溶液中水的电离程度与纯水相同
B.由醋酸铵溶液呈中性可推知NH4HCO3溶液pH<7
C.1mol/L醋酸铵溶液中c(CH3COO-)<1mol/L
D.在99mL的醋酸铵溶液中加入1mL pH=2的盐酸,所得溶液pH=4
难度: 中等查看答案及解析
-
下列溶液中,说法正确的是
A.NaHCO3溶液中可以大量存在NO
、AlO
、K+、S2-等离子
B.室温下0.1 mol/L的NaOH溶液与pH=1的某酸HA等体积混合后,溶液中C(Na+)≥C(A-)
C.1 mol/L的醋酸溶液加水稀释时,溶液中所有离子浓度均减小
D.t℃时,水的离子积常数为Kw,则[c(OH-)]2=Kw的水溶液一定呈中性
难度: 困难查看答案及解析
-
在密闭容器中发生反应:aX(g)+bY(g)
cZ(g)+ dW(g)。反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡后,W的浓度为原平衡状态的1.8倍,下列叙述正确的是
A.x的转化率变小 B.(a+b)>(c+d)
C.z的体积分数变大 D.平衡向正反应方向移动
难度: 中等查看答案及解析
-
已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
①生成物的百分含量一定增加 ②生成物的产量一定增加
③反应物的转化率一定增大 ④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂
A.①② B.②⑤ C.⑤ D.④⑥
难度: 中等查看答案及解析
-
如图中的曲线是表示其他条件一定时,2NO(g)+O2(g)
2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
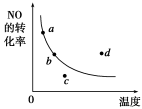
A.a点 B.b点 C.c点 D.d点
难度: 中等查看答案及解析
-
合成氨反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图
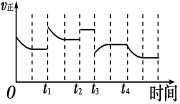
下列说法正确的是
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
难度: 中等查看答案及解析
-
将浓度为0.1 mol·L-1 HF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.Ka(HF) C.
D.
难度: 中等查看答案及解析
-
已知在100 ℃的温度下,水的离子积Kw=1×10-12,本题涉及的溶液温度均为100 ℃。下列说法中正确的是
A.0.001 mol·L-1的H2SO4溶液,pH=2
B.0.001 mol·L-1的NaOH溶液,由水电离出来的C(H+)=1×10-11 mol·L-1
C.0.005 mol·L-1的H2SO4溶液与0.01 mol·L-1的NaOH溶液等体积混合,混合溶液的pH为6,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要pH=9的NaOH溶液50 mL
难度: 中等查看答案及解析
-
将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为
A.9 B.10 C.11 D.12
难度: 中等查看答案及解析
-
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是
A.取NaOH溶液时仰视读数
B.滴定结束后,滴定管尖嘴处有一悬挂液滴
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2次~3次
难度: 中等查看答案及解析