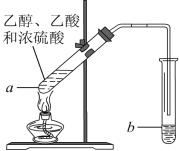
-
苯环结构中,不存在单双键交替结构,可以作为证据的事实是( )
①苯不能使KMnO4酸性溶液褪色;
②苯中的碳碳键的键长均相等;
③苯能在一定条件下跟H2加成生成环己烷;
④苯在FeBr3存在的条件下同液溴可发生取代反应,但不因化学变化而使溴水褪色。
A. ②③④ B. ①③④ C. ①②③ D. ①②④
难度: 中等查看答案及解析
-
某些建筑材料含有放射性元素氡(
),会对人体产生一定危害。研究表明氡的α射线会致癌,WHO认定的19种致癌因素中,氡为其中之一。该原子中中子数和质子数之差是( )
A.136 B.50 C.86 D.222
难度: 简单查看答案及解析
-
糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是
A.植物油不能发生水解反应 B.淀粉水解的最终产物是葡萄糖
C.葡萄糖能发生氧化反应和水解反应 D.蛋白质水解的产物为纯净物
难度: 中等查看答案及解析
-
A、B两元素电子层数相同,如果A原子半径比B大,则下列判断正确的是 ( )
A.两元素形成的最高价氧化物对应的水化物的酸性应是A强于B
B.A的气态氢化物比B的气态氢化物稳定
C.A的金属性比B的金属性强
D.A的阴离子比B的阴离子还原性弱
难度: 简单查看答案及解析
-
绿色化学中,最理想的“原子经济”是原子利用率为100%。下列反应类型最能体现“原子经济性”原则的是
①取代反应 ②加成反应 ③酯化反应 ④水解反应 ⑤加聚反应
A.①② B.③④ C.②⑤ D.②④
难度: 简单查看答案及解析
-
下列金属冶炼的反应原理,错误的是( )。
A.2NaCl(熔融)
2Na+Cl2↑
B.MgO+H2
Mg+H2O
C.Fe3O4+4CO
3Fe+4CO2
D.2HgO
2Hg+O2↑
难度: 简单查看答案及解析
-
下列过程中,共价键被破坏的是
A.HCl气体溶于水 B.溴蒸气被活性炭吸附 C.葡萄糖溶于水 D.碘升华
难度: 简单查看答案及解析
-
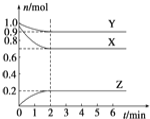
把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)
nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为
A.1 B.3 C.2 D.4
难度: 简单查看答案及解析
-
已知一定温度时:
。当生成2mol SO3时,放出热量197kJ,在相同温度和压强下,向密容器中通入3mol SO2和1molO2,达到平衡时放出热量Q,则下列关系式中正确的是
A.Q=197 kJ B.Q<197×2 kJ C.Q<197 kJ D.Q>197 kJ
难度: 简单查看答案及解析
-
把纯净的甲烷与氯气混合气放在集气瓶中,用玻璃片盖好瓶口,放在光亮的地方一段时间后,下列说法中,不正确的是
A.气体发生爆炸反应 B.瓶内气体的颜色变浅
C.用一根蘸有浓氨水的玻璃棒伸入瓶内时有白烟产生 D.集气瓶壁有油状液体生成
难度: 简单查看答案及解析
-
下列各组物质中,互为同分异构体的是( )
A. 水与冰
B. O2与O3
C.
与
D.
与
难度: 中等查看答案及解析
-
某有机物的结构简式如图,该物质应有的化学性质是
①可燃烧;②可跟溴加成;③可使酸性KMnO4溶液褪色;④可跟NaHCO3溶液反应⑤可跟Cu(OH)2悬浊液反应;⑥可跟金属钠反应
A. ①②③⑥ B. ②③④⑥ C. ②③④⑤⑥ D. ①②③④⑤⑥
难度: 中等查看答案及解析
-
对于可逆反应H2(g)+I2(g)
2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是
A.H2(g)的消耗速率与HI(g)的生成速率之比为2:1
B.正、逆反应速率的比值是恒定的
C.达到平衡时,正、逆反应速率相等
D.达到平衡时,H2(g)和I2(g)浓度不在变化且相等
难度: 简单查看答案及解析
-
高温下,炽热的铁与水蒸气在一个体积可变的密闭容器中进行反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是 ( )
A.把铁块变成铁粉 B.将容器的体积缩小一半
C.压强不变,充入氮气使容器体积增大 D.体积不变,充入氮气使容器压强增大
难度: 中等查看答案及解析
-
已知自然界氧的同位素有16O、17O、18O,与氢的其中两种同位素H、D组成水分子,从水分子的原子组成来看,此水一共有
A.3种 B.18种 C.9种 D.12种
难度: 简单查看答案及解析
-
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
B.若X(OH)n为强碱,则Y(OH)n也一定为强碱
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
难度: 简单查看答案及解析
-
在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2mol•L-1 降到 0.8mol•L-1 需要 20s,那么反应物浓度再由 0.8mol•L-1 降到 0.2mol•L-1 所需要的时间为
A.10s B.大于 10s C.小于 10s D.无法判断
难度: 中等查看答案及解析
-
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
难度: 简单查看答案及解析
-
两种气态烃组成的混合气体0.1mol, 完全燃烧得0.16molCO2和3.6g水。下列说法正确的是 ( )
A.混合气体一定没有甲烷 B.混合气体中一定是甲烷和乙烯
C.混合气体中一定没有乙烷 D.混合气体中一定有乙烯
难度: 困难查看答案及解析
-
.高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁做电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是
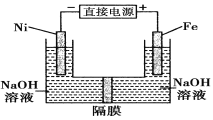
A.铁是阳极,电极反应为Fe-6e-+4H2O===FeO42-+8H+
B.镍电极上的电极反应为2H2O+2e-==H2↑+2OH-
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,最终溶液pH不变
难度: 中等查看答案及解析