-
化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A.“霾尘积聚难见路人”,雾霾所形成的溶胶能产生丁达尔效应
B.“青蒿一握,以水二升渍,绞取汁”,上述对青蒿素的提取过程属于化学变化
C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
难度: 中等查看答案及解析
-
下列有关有机物的说法正确的是( )
A.乙烯、氯乙烯、聚乙烯均可以使酸性高锰酸钾溶液褪色
B.1mol苹果酸[HOOCCH(OH)CH2COOH]可与3molNaHCO3发生反应
C.酸性条件下,C2H5CO18OC2H5的水解产物是C2H5CO18OH和C2H5OH
D.乙酸和油脂都能与氢氧化钠溶液反应
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是( )
选项
实验目的
实验操作
A
配制100 mL浓度为0.10 mol·L-1的KMnO4溶液
称取KMnO4固体1.58 g,放入100 mL容量瓶中,加水溶解并稀释至刻度线处
B
用废蚀刻液(含FeCl2、FeCl3、CuCl2、HCl)制备FeCl2溶液
向废蚀刻液中加入过量铁粉、充分搅拌、过滤
C
检验木炭与浓硫酸反应的气态产物中含SO2和CO2
将产生的气体依次通过澄清石灰水和品红溶液
D
检验乙醇中羟基氢的活泼性
将金属钠投入到盛有医用酒精的烧杯中
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列实验能达到实验目的而且符合实验设计要求的是( )
A.排水法测定SO2的体积
B.加热AlCl3溶液制AlCl3
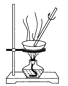
C.探究铬和镍的金属活动性
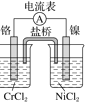
D.氯气与铁粉反应制FeCl3

难度: 中等查看答案及解析
-
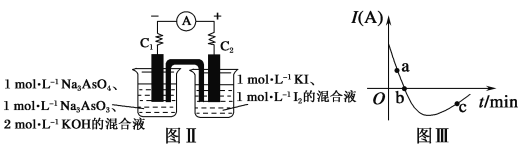
锂空气充电电池有望成为电动汽车的实用储能设备。工作原理示意图如下,下列叙述正确的是
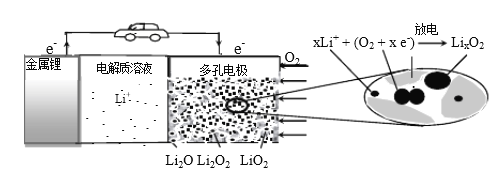
A.该电池工作时Li+向负极移动
B.Li2SO4溶液可作该电池电解质溶液
C.电池充电时间越长,电池中Li2O 含量越多
D.电池工作时,正极可发生: 2Li+ +O2+ 2e-=Li2O2
难度: 中等查看答案及解析
-
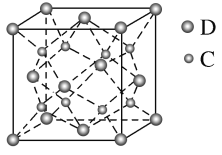
X、Y、Z、W、R属于短周期主族元素。X的原子半径在短周期主族元素中最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2∶1。下列叙述错误的是
A.X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B.Y的氢化物比R的氢化物稳定,熔沸点高
C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D.RY2、WY2通入BaCl2溶液中均有白色沉淀生成
难度: 中等查看答案及解析
-
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随
的变化如图所示,下列叙述错误的是( )
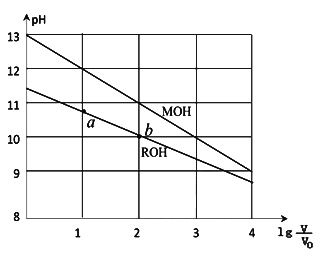
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当
=2时,若两溶液同时升高温度,则
增大
难度: 中等查看答案及解析