-
主族元素Q、X、Y、Z、W的原子序数依次增大,且均不大于20。Q的简单氢化物和其最高价含氧酸可以化合成盐,X与Q同周期且是该周期主族元素中原子半径最小的元素;Z一具有与氩原子相同的电子层结构;Q、Y、W原子的最外层电子数之和为9。下列说法一定正确的是
A.X与Z的简单氢化物的水溶液均呈强酸性
B.Y与Z形成的化合物只含离子键
C.简单氢化物的沸点:Q<X
D.Z和W形成的化合物的水溶液呈碱性
难度: 困难查看答案及解析
-
化学与生产和生活密切相关。下列有关说法正确的是
A.古代记载文字的器物“甲骨”与 “丝帛”成分相同
B.苏打可用于制作发酵粉,在医疗上也可以用作治疗胃酸过多
C.我国自主研发的“龙芯 4000 系列”CPU 芯片与光导纤维是同种材料
D.用于制作 N95 型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯的分子长链上有支链
难度: 简单查看答案及解析
-
厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中不正确的是
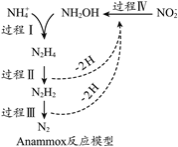
A.1mol NH4+ 所含的质子总数为10NA
B.联氨(N2H4)中含有极性键和非极性键
C.过程II属于氧化反应,过程IV属于还原反应
D.过程I中,参与反应的NH4+与NH2OH的物质的量之比为1:1
难度: 中等查看答案及解析
-
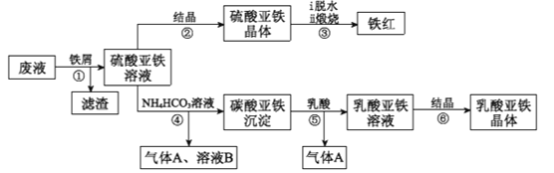
某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2·6H2O,设计了如下流程:
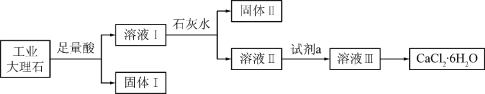
下列说法不正确的是
A. 固体I中含有SiO2,固体II中含有Fe(OH)3
B. 使用石灰水时,要控制pH,防止固体II中Al(OH)3转化为AlO2-
C. 试剂a选用盐酸,从溶液III得到CaCl2·6H2O产品的过程中,须控制条件防止其分解
D. 若改变实验方案,在溶液I中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2·6H2O
难度: 中等查看答案及解析
-
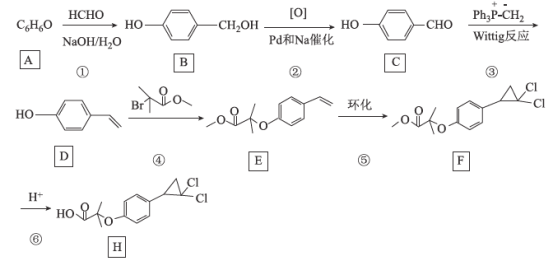
酮洛芬是优质抗炎镇痛药,合成原理如下:
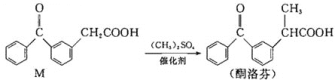
下列说法正确的是( )
A.M和酮洛芬都能发生酯化、卤代和加成反应
B.M和酮洛芬分子中所有碳原子都可能共平面
C.M和酮洛芬在一定条件下最多消耗
的物质的量相等
D.M分子中苯环上一氯代物有9种
难度: 中等查看答案及解析
-
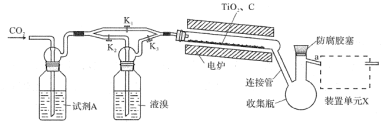
国内某科技研究小组首次提出一种新型的Li+电池体系,该体系正极采用含有I-、Li+的水溶液,负极采用固态有机聚合物,电解质溶液采用LiNO3溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。已知:I-+I2
I3-,下列有关判断正确的是
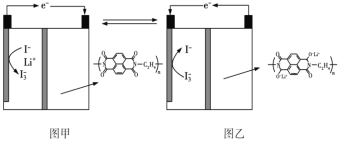
A.图甲是原电池工作原理图,图乙是电池充电原理图
B.放电时,正极液态电解质溶液的颜色加深
C.充电时,Li+从右向左通过聚合物离子交换膜
D.放电时,负极的电极反应式为
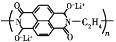 -2ne-=
-2ne-=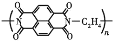 +2nLi+
+2nLi+难度: 中等查看答案及解析
-
在25℃时,甘氨酸在水溶液中解离情况如下:H3N+CH2COOH(A+)
H3N+CH2COO-(A±)
H2NCH2COO-(A-),改变溶液pH值,三种甘氨酸相关离子的分布分数(α,平衡时某物种的浓度占各物种浓度之和的分数)变化如图所示。当调节溶液的pH值使甘氨酸所带的净电荷为零,此时溶液的pH叫等电点。下列说法正确的是( )
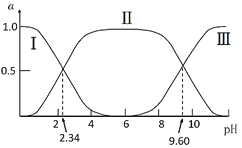
A.曲线Ⅰ、Ⅱ、Ⅲ分别代表的微粒为A−、A±、A+
B.K2=10−2.34,且K2对应的解离基团为-NH3+
C.在pH=9.60的溶液中加盐酸,α(A±)+α(A+)+α(A−)保持不变
D.甘氨酸的等电点pH约为6,且存在c(A±)=c(A+)=c(A−)
难度: 中等查看答案及解析