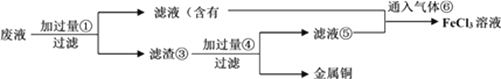
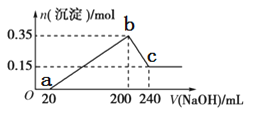
-
将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有白色沉淀产生的是( )
①MgSO4溶液 ②Na2SO4稀溶液 ③饱和澄清石灰水 ④Ca(HCO3)2溶液 ⑤CuSO4溶液 ⑥饱和NaCl溶液 ⑦FeCl3溶液
A. ①④⑤⑦ B. ②④⑤⑥ C. ③④⑤⑦ D. ①③④⑥
难度: 简单查看答案及解析
-
下列判断正确的是( )
①足量金属Na与标准状况下11.2LO2反应时一定转移2 mol电子
②金属与氧气反应时都生成最高价金属氧化物
③金属钠与H2O反应生成NaOH,金属铜也能与H2O反应生成Cu(OH)2
④Na2O2与足量H2O反应时,每生成1mol O2转移电子的数目为2NA
⑤Na2O2遇到紫色石蕊试剂后,石蕊试剂最终变成蓝色
⑥78gNa2O2与CO2充分反应后,固体质量增加了56g
A.①②③ B.②③⑤ C.②④⑥ D.④
难度: 中等查看答案及解析
-
烟火璀璨耀首都,火树银花庆国庆。在新中国成立70周年国庆联欢晚会上,最后的烟花表演用璀璨的焰火点亮了北京的夜空,惊艳了无数国人。这与高中化学中“焰色反应”知识相关,下列说法中正确的是
A.焰色反应是化学变化
B.利用焰色反应可区分NaCl与Na2CO3固体
C.透过蓝色钴玻璃观察到焰色为紫色,则待测液一定含钾盐
D.用稀盐酸清洗做焰色反应的铂丝(或铁丝)
难度: 中等查看答案及解析
-
为了除去粗盐中的少量泥沙和Ca2+、Mg2+、SO42-等杂质离子,先将粗盐溶于水,过滤,然后对滤液进行4项操作:①过滤,②加适量盐酸 ,③加过量的NaOH和Na2CO3混合溶液④加过量BaCl2溶液。上述4项操作的正确顺序为
A.②③④① B.④②③① C.④③①② D.②①③④
难度: 困难查看答案及解析
-
下列反应的离子方程式中,书写正确的是 ( )
A.钠跟水反应:Na + 2H2O = Na+ + 2OH- + H2↑
B.向硫酸溶液中加入Ba(OH)2溶液: H++SO42-+Ba2++OH- =H2O+BaSO4↓
C.向A12(SO4)3溶液中加入过量的氨水:A13++3NH3·H2O=A1(OH)3↓+3NH4+
D.FeCl2溶液跟Cl2反应:Fe2++Cl2 == Fe3++2Cl-
难度: 中等查看答案及解析
-
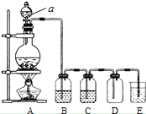
下列操作或装置能达到实验目的的是
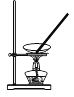
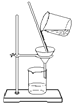

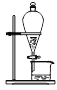
A.灼烧 B.分离Fe(OH)3胶体 C.制备蒸馏水 D.分离酒精和水
难度: 简单查看答案及解析
-
2018年11月13日第26届国际计量大会对国际单位制进行修改。新的摩尔的定义规定,1摩尔物质包括阿伏加德罗常数NA个基本单元。下列有关阿伏加德罗常数NA的说法正确的是( )
A.常温常压下,11gCO2中含有0.75NA个原子
B.2.4g镁变成镁离子时,失去的电子数目为0.1NA
C.标准状况下,NA个水分子的体积约为22.4L
D.1L 0.3mol/L的NaCl溶液中含有0.3NA个NaCl分子
难度: 中等查看答案及解析
-
下列说法正确的是
A.氯水能导电,所以氯气是电解质
B.碳酸钙难溶于水,所以它是非电解质
C.固体磷酸是电解质,所以磷酸在熔融状态下和溶于水时都能导电
D.胆矾虽不能导电,但它属于电解质
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 将饱和FeCl3溶液逐滴加入NaOH溶液中可制得Fe(OH)3胶体
B. 雾属于分散系中的胶体,它的分散剂是水蒸气
C. 胶体区别于其它分散系的本质特征是丁达尔效应
D. 向Fe(OH)3胶体中逐滴加入稀硫酸至过量,先生成红褐色沉淀最后沉淀溶解
难度: 中等查看答案及解析
-
在某无色透明的酸性的溶液中能共存的离子组是( )
A.NH4+、NO3-、Al3+、Cl- B.Fe2+、K+、Cl-、NO3-
C.MnO4-、K+、SO42-、Na+ D.K+、SO42-、HCO3-、Na+
难度: 中等查看答案及解析
-
已知反应:①Cl2+2KBr=2KCl+Br2;②KClO3+6HCl=3Cl2↑+KCl+3H2O;③2KBrO3+Cl2=Br2+2KClO3。下列说法正确的是:( )
A.①中KCl 是氧化产物,KBr发生还原反应
B.氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2
C.反应②中氧化剂与还原剂的物质的量之比为1:6
D.③中1 mol氧化剂参加反应得到电子的物质的量为2.5 mol
难度: 中等查看答案及解析
-
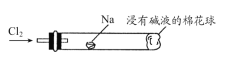
下列关于钠单质性质的叙述中不正确的是()
A.在空气中极易被氧化,常保存在煤油
B.能与氯化铜溶液反应生成氯化钠和铜
C.是一种银白色金属,具有金属光泽
D.在空气中燃烧火焰为黄色
难度: 简单查看答案及解析
-
在杠杆的两端分别挂着质量相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在溶液质量相等的稀烧碱溶液和硫酸铜溶液中一段时间,如图所示。下列说法正确的是( )
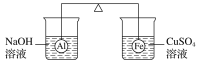
A.铝球表面有气泡产生,且有白色沉淀生成,杠杆不平衡
B.铝球表面有气泡产生,溶液澄清;铁球表面有红色物质析出,杠杆右边下沉
C.反应后去掉两烧杯,杠杆仍平衡
D.右边球上出现红色,左边溶液的c(OH-)增大
难度: 困难查看答案及解析
-
下列关于碳酸钠和碳酸氢钠的比较中不正确的是( )
A.二者在水中的溶解度不同,碳酸氢钠的溶解度小于碳酸钠
B.二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠
C.二者都能与盐酸反应放出二氧化碳气体,等质量时生成CO2量一样多
D.二者在一定条件下可以相互转化
难度: 中等查看答案及解析
-
下列有关硅材料的说法不正确的是( )
A. 晶体硅是良好的半导体材料和制作太阳能电池的材料
B. SiO2可用于制造光导纤维
C. 普通玻璃是以纯碱、石灰石和石英为原料经高温烧结而制成的
D. SiO2是酸性氧化物,它可溶于水生成硅酸
难度: 简单查看答案及解析