-
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是
X
Y
W
Z
T
A.原子半径:X>Y>Z
B.X、Y、Z三种元素最低价氢化物的沸点依次升高
C.由X、Y和氢三种元素形成的化合物中只有共价键
D.T元素的单质具有半导体的特性
难度: 简单查看答案及解析
-
下列物质属于盐的是
A.Mg(OH)2 B.Al2O3 C.Cu2(OH)2CO3 D.CH3CH2OH
难度: 简单查看答案及解析
-
下列仪器名称为“坩埚”的是
A.
B.
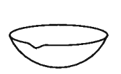 C.
C.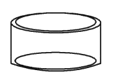 D.
D.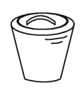
难度: 简单查看答案及解析
-
下列物质属于电解质且能导电的是
A.酒精 B.金属铜 C.液态硝酸 D.熔融氯化钾
难度: 简单查看答案及解析
-
下列反应中,非金属单质只作氧化剂的是( )
A. Br2+2NaOH=NaBr+NaBrO+H2O B. 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
C. C+2CuO
2Cu+CO2↑ D. 4Fe(OH)2+O2+2H2O=4Fe(OH)3
难度: 简单查看答案及解析
-
人类生活离不开化学知识,下列叙述不正确的是
A.臭氧是饮用水的理想消毒剂之一,因为它杀菌能力强且不影响水质
B.因患“禽流感”而被捕杀的家禽尸体常用生石灰处理
C.新冠病毒可以用体积分数为 75%的酒精进行消毒
D.食品加工、消毒、防腐常使用福尔马林
难度: 简单查看答案及解析
-
下列说法不正确的是
A.二氧化硫可用于漂白纸浆
B.热的纯碱溶液可以去除厨房里的油污
C.目前用于饮用水净化的含铝净水剂正逐步被含铁净水剂所取代
D.钢铁因含杂质而容易生锈,所以合金一定不耐腐蚀
难度: 简单查看答案及解析
-
下列表示不正确的是
A.16O2-离子结构示意图
B.CF4 的球棍模型:
C.氯化钠的化学式:NaCl D.乙炔的结构式:CH≡CH
难度: 简单查看答案及解析
-
下列有关硝酸的说法正确的是
A.工业硝酸的质量分数约为 69%,常因溶有少量NO而略显黄色
B.硝酸是一种氧化性很强的酸,可以与金、铂等金属反应
C.将木炭放入浓硝酸中,可立即观察到有气泡生成
D.工业制备硝酸第三步为用水吸收二氧化氮生成硝酸
难度: 简单查看答案及解析
-
下列说法正确的是
A.纸层析法时,亲脂性成分在固定相中分配的多一些,随流动相移动的速度快一些
B.溶解度越小,溶液浓度越大,溶剂蒸发的越快,溶液冷却的越快,析出的晶体越小
C.吸滤瓶内与液体快到支管口时,应拔掉橡皮管,从支管口将液体倒出
D.可用亚硝酸钠和硝酸银溶液检验氯酸钾中的氯酸根离子
难度: 简单查看答案及解析
-
化学实验设计和操作中必须十分重视安全和环境保护问题。下列实验问题处理方法不正确的是
A.在制取氧气时用排水法收集氧气后出现倒吸现象,立即松开试管上的橡胶塞
B.在气体发生装置上直接点燃一氧化碳气体时,必须先检验一氧化碳气体的纯度
C.实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
D.给试管中的液体加热时不时移动试管或提前加入碎瓷片,以免暴沸伤人
难度: 简单查看答案及解析
-
下列说法正确的是
A.富勒烯包含C60、C70、碳纳米管等,它们互为同素异形体
B.H、D、T 互为同位素,中子数都为 1
C.
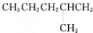 的名称是:4-甲基戊烷
的名称是:4-甲基戊烷D.C4H10 的一氯代物只有两种
难度: 简单查看答案及解析
-
下列指定反应的离子方程式不正确的是
A.氧化镁与盐酸反应:MgO+2H+===Mg2++H2O
B.0.3molFeI2与0.4molCl2在溶液中反应:6Fe2++10I-++8Cl2 =6Fe3++16Cl-+5I2
C.将足量CO2通入NaAlO2溶液中:CO2+AlO2-+2H2O===Al(OH)3↓+HCO3-
D.碳酸钠与足量醋酸反应:CO32-+2CH3COOH===CO2↑+H2O+2CH3COO-
难度: 简单查看答案及解析
-
反应 2SO2(g)+O2(g)
2SO3(g) ΔH<0,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是
A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,v(SO2)与 v(SO3)相等
D.容器内气体的浓度 c(SO2)∶c(O2)∶c(SO3)=2∶1∶2
难度: 简单查看答案及解析
-
下列说法正确的是
A.向苯中加入溴的四氯化碳溶液,振荡后静置分层,上层呈橙红色
B.含有 5 个碳的烃分子中最多可存在 4 个碳碳单键
C.乙酸和软脂酸互为同系物
D.将牛油和烧碱溶液混合加热,充分反应后加入热的饱和食盐水,下层析出高级脂肪酸盐
难度: 简单查看答案及解析
-
下列说法不正确的是
A.煤干馏得到煤焦油,煤焦油中含有苯、二甲苯等物质,可通过分馏进一步分离
B.环已烷与溴的四氯化碳溶液在光照条件下褪色,说明发生了取代反应
C.合成纤维、人造纤维及碳纤维都属于有机高分子材料
D.紫外线、加热、CuSO4 溶液的作用下,蛋白质均发生变性。某些变性的蛋白质仍可食用。
难度: 简单查看答案及解析
-
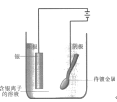
NO2 是大气污染的主要污染物之一,硝酸盐是水体污染的污染物之一,电化学降解酸性 NO3-的原理如图所示,下列说法正确的是

A.电源正极为 b
B.阴极电极反应式为 2NO3-+ 6H2O +10e-= N2↑+12 OH-
C.两电极上产生的气体物质的量之比 n(O2):n(N2) = 5:2
D.将阳极换成铜电极,反应不发生变化
难度: 简单查看答案及解析
-
常温下,浓度均为 0.1mol·L -1 的盐酸和醋酸,下列说法正确的是
A.分别与相同的镁粉反应,开始时两溶液中反应速率:盐酸等于醋酸
B.稀释相同倍数后两酸溶液的浓度:盐酸小于醋酸
C.用相同浓度的NaOH 溶液分别与等体积的盐酸和醋酸溶液恰好反应完全,消耗的NaOH 溶液的体积:盐酸大于醋酸
D.两种溶液中水电离出的氢离子浓度:盐酸小于醋酸
难度: 简单查看答案及解析
-
以下是中学化学常见的四个装置,下列关于这些装置说法正确的是
A.装置在使用过程中,电池内部电子从Ag2O 极通过隔板移向锌粉
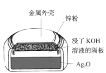
B.装置在使用过程中,电池外壳会逐渐变薄,容易出现漏液

C.装置在使用过程中,电解质溶液的 pH 不会发生变化

D.装置在使用过程中,阳极可以一直使用,不需要更换
难度: 简单查看答案及解析
-
设 NA为阿伏加德罗常数的值,下列说法不正确的是
A.2 mol SO2 和 1 mol O2 混合在 V2O5 存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA
B.某温度下纯水的 pH=6,该温度下 1L pH=11 的NaOH 溶液中含OH-的数目为 0.1NA
C.一定温度下,1 L 0.5 mol·L -1 NH4Cl 溶液与 2 L 0.25 mol·L -1NH4Cl 溶液含NH+均为 0.5NA
D.100 g CaCO3 与 KHCO3 的混合物中含有的阴离子的数目为 NA
难度: 简单查看答案及解析
-
由反应物X 转化为 Y 或 Z 的能量变化如图所示。下列说法正确的是
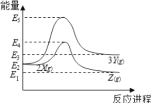
A.由X→Z反应的ΔH=E2-E1
B.反应2X(g) = 3Y(g)的活化能=E3-E2
C.2X(g) = Z(s) ΔH<E1-E2
D.由图可知,X(g)、Y(g)、Z(g)的稳定性情况为:Z(g)>X(g)>Y(g)
难度: 简单查看答案及解析
-
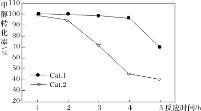
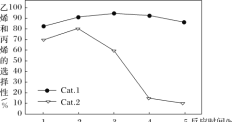
某中学化学小组查阅资料发现金属氧化物R也能催化氯酸钾的分解,且R和二氧化锰的最佳催化温度均在500℃左右,于是对R和二氧化锰的催化性能进行了定量对照实验。实验时均以收满500mL氧气为准(其他可能影响实验的因素均已忽略)。
表 1 用 MnO2 作催化剂
实验序号
KClO3 质量(g)
MnO2 质量(g)
反应温度(℃)
待测数据
1
8.00
1.00
500
a
2
8.00
2.00
500
b
表 2 用R 作催化剂
实验序号
KClO3 质量(g)
R 质量(g)
反应温度(℃)
待测数据
3
8.00
1.00
500
c
4
8.00
2.00
500
d
下列说法不正确的是
A.待测数据一定为时间
B.实验测得 a>b,说明适当增加催化剂的量可以加快反应速率
C.通过实验 2 和 4 可比较 MnO2 和催化剂R 的催化效果
D.升高温度,实验 3 中c 的值一定会减小
难度: 简单查看答案及解析
-
常温下,用 0.10 mol/LKOH 溶液滴定 10.00mL 0.10 mol/L 某二元弱酸H2R 溶液,滴定曲线如图(混合溶液总体积看作混合前两种溶液体积之和),下列关系不正确的是
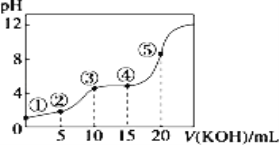
A.点②所示溶液中:c(K+)+c(H+)=c(HR-)+2c(R2-)+c(OH-)
B.点③所示溶液中:c(K+)> c(HR-)> c(R2-)>c(H2R)
C.点④所示溶液中:c(H2R)+ c(HR-)+ c(R2-)=0.04mol·L-1
D.点⑤所示溶液中:c(H+)= c(HR-)+2 c(H2R)+ c(OH-)
难度: 简单查看答案及解析
-
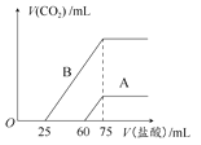
已知:将 Cl2通入适量 NaOH 溶液,产物中可能有 NaCl、NaClO、NaClO3,且
的值仅与温度高低有关。当n(NaOH)=6a mol 时,下列有关说法不正确的是
A.参加反应的氯气的物质的量 3amol
B.改变温度,产物中NaCl 的最小理论产量为 3a mol
C.改变温度,反应中转移电子的物质的量 n 的范围:3a mol≤n≤5a mol
D.某温度下,反应后
,则溶液中
难度: 中等查看答案及解析
-
下列化学实验事实及其解释或结论都正确的是
A.取少量溶液X,向其中加入适量新制氯水,再加几滴 KSCN溶液,溶液变红,说明X 溶液中一定含有Fe2+
B.将某固体试样完全溶于盐酸,再滴加BaCl2 溶液,出现白色沉淀,则该固体试样中存在 SO42-
C.某待测溶液可能含有等浓度的下列离子中的若干种:K+、Na+、NH4+、Mg2+、Fe2+、Fe3+、I-、CO32-、SO42-。现取少量待测溶液于试管,加入足量NaOH 溶液得到白色沉淀,加热产生无色气体,则原溶液中是否含有K+、Na+,需通过焰色反应确定
D.向 CuSO4 溶液中加入 KI 溶液,有白色沉淀生成;再加入四氯化碳振荡,四氯化碳层呈紫色, 白色沉淀可能为CuI
难度: 简单查看答案及解析