-
下列叙述中正确的是
A.使用含微量NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F以防止蛀牙,则一般可说明后者的Ksp小于前者的Ksp
B.室温下向苯和含少量苯酚杂质的混合溶液中加入适量浓溴水,振荡,静置后过滤,可除去苯中少量苯酚杂质
C.用1.00mol/L 标准盐酸滴定未知浓度的NaOH溶液10.00mL,滴定前将25.00mL 酸式滴定管中盐酸调至“0”刻度,将盐酸滴完恰好滴定至终点,则可得c(NaOH)=2.50mol/L
D.向4ml 2%的CuSO4溶液中加入几滴1%的NaOH溶液,振荡后再加入0.5mL 有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基
难度: 中等查看答案及解析
-
我国古代的青铜器工艺精湛,有很高的艺术价值和历史价值。下列说法不正确的是
A.我国使用青铜器的时间比使用铁器、铝器的时间均要早
B.将青铜器放在银质托盘上,青铜器容易生成铜绿
C.《本草纲日》中载有一药物,名“铜青”,铜青是铜器上的绿色物质,则铜青就是青铜
D.用蜂蜡做出铜器的蜡模,是古代青铜器的铸造方法之一,蜂蜡的主要成分是有机物
难度: 中等查看答案及解析
-
用制溴苯的废催化剂(主要含FeBr3及少量溴、苯)为原料,制取无水FeCl3和溴的苯溶液,选用的方法能达到相应实验目的的是
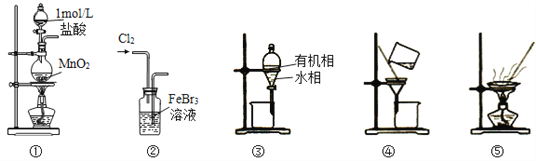
A. 用装置①及其试剂制取氯气
B. 用装置②氧化FeBr3溶液中的溴离子
C. 用装置③分离出FeCl3溶液,不能选用装置④分离
D. 用装置⑤将FeCl3溶液蒸发至干,可得无水FeCl3
难度: 中等查看答案及解析
-
已知:还原性HSO3->I-,氧化性IO3->I2。在含3mol NaHSO3的溶液中逐滴加人KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是
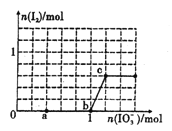
A. 0-a段发生反应:3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b段共消耗NaHSO3的物质的量为1.8mol
C. b~c段反应:氧化产物为I2
D. 当溶液中I-与I2的物质的量之比为5 : 1时,加入的KIO3为1.lmol
难度: 困难查看答案及解析
-
化合物X(5没食子酰基奎宁酸)具有抗氧化性和抗利什曼虫活性而备受关注,X的结构简式如图所示。下列有关X的说法正确的是( )
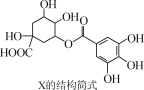
A.分子式为C14H15O10
B.该分子可由酯化反应制得
C.1 mol X最多可与4 mol NaOH反应
D.1 mol X最多可与4 mol NaHCO3反应
难度: 中等查看答案及解析
-
柠檬酸(用H3R表示)可用作酸洗剂。常温下,向0.1mol·L−1 H3R溶液中加入少量的NaOH固体(忽略溶液体积的变化),H3R、H2R−、HR2−和R3−的含量与pH的关系如图所示。下列正确的是
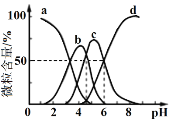
A. 图中b曲线表示HR2−的变化
B. HR2−的电离常数Ka3=10−6
C. pH=7时,c(Na+)=c(H2R−)+c(HR2−)+c(R3−)
D. pH=5时,c(H2R−)+c(HR2−)+c(R3−)=0.1mol·L−1
难度: 中等查看答案及解析




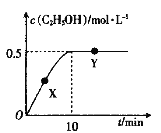
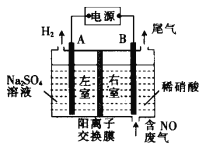

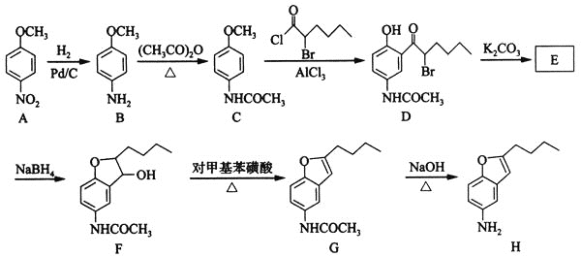
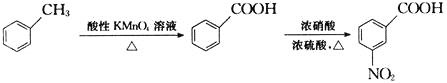
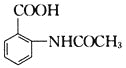 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___________________________
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___________________________