-
下列说法中错误的是( )
A.采煤工业爆破时把干冰和炸药放在一起,既能增强爆炸威力,又能预防火灾
B.国产大型飞机C919使用的碳纤维是一种新型的无机非金属材料
C.《肘后急备方》“青蒿一握,以水二升渍,取绞汁”,该过程属于物理变化
D.高级脂肪酸乙酯是生物柴油的一种成分,它属于油脂
难度: 简单查看答案及解析
-
国际计量大会第26次会议新修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),并于2019年5月20日正式生效。下列说法正确的是( )
A.在Al3+数目为NA的AlCl3溶液中,Cl-总数为3 NA
B.常温下,42g乙烯和丙烯的混合物中所含H原子的数目是6 NA
C.4molNH3与6molO2在催化剂和加热条件下充分反应,所得产物中NO的分子数是4 NA
D.常温常压下,2g羟基(
)中所含的中子数为NA
难度: 中等查看答案及解析
-
从山道年蒿中提取出一种具有明显抗癌活性的有机物X,其结构简式如图所示,下列有关说法错误的是( )
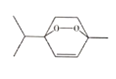
A.该物质的分子式为C10H16O2
B.该物质能发生氧化反应、还原反应、加聚反应和取代反应
C.该物质的一氯代物共有5种
D.该物质所有的碳原子不可能共平面
难度: 中等查看答案及解析
-
《JournalofEnergyChemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是( )
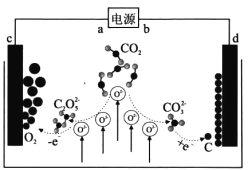
A.b为正极 B.熔盐可用KOH溶液代替
C.d极电极反应式为CO32-+4e-═C+3O2- D.转移1mol电子可捕获CO25.6L
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、M的原子序数依次增大,其中X、Y、Z三种元素中,可形成含二种元素的10电子微粒m,n,p,q,且有反应m+n
p↑+q;M的最高价氧化物对应的水化物为无机含氧酸中的最强酸,则下列说法正确是( )
A.原子半径X<M<Z<Y
B.简单氢化物的沸点Z>M>Y
C.X、Y、Z三种元素组成的化合物的水溶液可能呈碱性,可能呈酸性
D.MZ2不可用于自来水的杀菌消毒
难度: 中等查看答案及解析
-
下列实验操作,现象及结论都正确的是( )
选项
实验操作
现象
结论
A
向装有经过硫酸处理的CrO3(橘红色)的硅胶导管中吹入乙醇蒸汽
固体逐渐由橘红色变为浅绿色(Cr3+)
乙醇具有还原性
B
向稀氨水和酚酞混合溶液中加入少量Ag2O,振荡
溶液由浅红色变为红色
Ag2O是强碱
C
取两支试管,分别加4mL0.01mol/L和4mL0.02mol/L的KMnO4溶液,然后向两支试管中各加入2mL0.02mol/LH2C2O4溶液,分别记录两支试管中溶液褪色所需的时间
第二支试管溶液褪色所需的时间更短
其他条件相同时,增大反应物浓度反应
速率增大
D
取少许CH3CH2Br与NaOH溶液共热,冷却后滴加AgNO3溶液
无淡黄色沉淀
CH3CH2Br没有水解
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
工业生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如图,下列有关说法不正确的是( )

A.生成沉淀的离子方程式为:
B.原NaHCO3溶液中
=0.8mol/L
C.a点溶液中存在:
D.a点水的电离程度小于b点水的电离程度
难度: 困难查看答案及解析

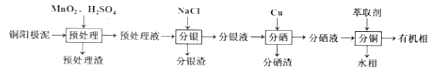
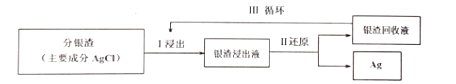
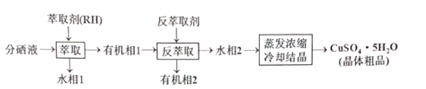


 +CH3CH2OH
+CH3CH2OH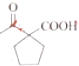 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。