-
化学与生活、生产密切相关,下列叙述正确的是
A.用含橙色的酸性重铬酸钾溶液的仪器检验酒驾,利用了乙醇的挥发性和还原性。
B.空气污染日报中的空气污染指数的主要项目有可吸入颗粒物、二氧化硫、二氧化氮和二氧化碳
C.为消除碘缺乏症,我国卫生部门规定食盐中必须加碘,其中碘元素以KI形式存在
D.为了获得更好的消毒效果,医用酒精的浓度通常为95%
难度: 简单查看答案及解析
-
止血环酸的结构如下图所示,用于治疗各种出血疾病,在一些牙膏中也含有止血环酸。下列说法不正确的是
A.该物质的分子式为C8H15NO2
B.在光照条件下与Cl2反应生成的一氯代物有4种
C.该物质能发生取代反应、置换反应
D.止血原理可看做是胶体的聚沉
难度: 简单查看答案及解析
-
W、X、Y、Z是原子序数依次增大的短周期主族元素。已知W原子的最外层电子数是电子层数的2倍,X元素存在两种气态同素异形体,一种可吸收大气中的紫外线,Y原子最外层电子数等于电子层数,Z离子在同周期最简单阴离子中,半径最小。下列说法正确的是
A.W的氢化物沸点一定低于X的氢化物沸点
B.简单离子半径: X > Y > Z
C.X的一种单质和Z的某种化合物都可用于污水的杀菌消毒
D.Y、Z形成的离子化合物溶于水,阴、阳离子数目比为3:1
难度: 简单查看答案及解析
-
用下列装置进行实验,能达到实验目的的是
选项
A
B
C
D
实验装置
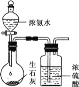

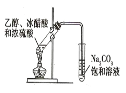
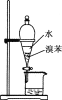
目的
制备干燥的氨气
证明非金属性
Cl>C>Si
制备乙酸乙酯
分离出溴苯
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,4.48L 空气中所含原子数为0.2NA
B.常温常压下,2.3g NO2和N2O4的混合物中含有的氧原子数为0.2NA
C.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2 NA
D.常温下,0.1 mol·L-1Na2CO3溶液中阴离子总数大于0.1 NA
难度: 简单查看答案及解析
-
下列根据实验操作和现象得出的结论不正确的是
选项
操作及现象
结论
A
将乙烯气体通入酸性KMnO4溶液中,
溶液褪色
乙烯具有还原性
B
将少量浓硫酸滴到蔗糖表面,蔗糖变黑,体积膨胀
浓硫酸有脱水性和强氧化性
C
向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液, 出现白色沉淀
溶液X 中可能含有SO32-
D
向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热,无红色沉淀
淀粉未水解
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
某温度下,0.200 mol·L-1的HA溶液与0.200 mol·L-1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法正确的是
微粒
X
Y
Na+
A-
浓度/(mol•L-1)
8.00×10-4
2.50×10-10
0.100
9.92×10-2
A.0.1 mol·L-1HA溶液的pH=1
B.该温度下Kw=1.0×10-14
C.微粒X表示OH-,Y表示H+
D.混合溶液中:n(A-)+n(X)=n(Na+)
难度: 中等查看答案及解析


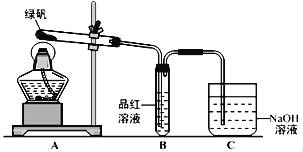
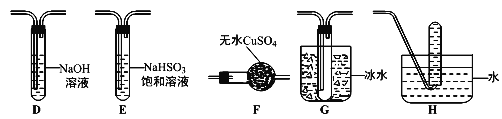
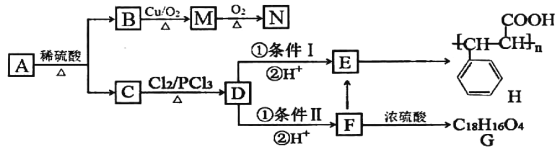
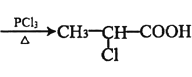 +HCl
+HCl