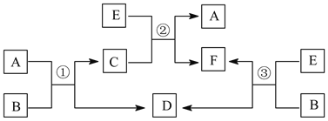
-
将总物质的量为n mol的钠和铝的混合物(其中钠的物质的量分数为x),投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V L。下列关系式中正确的是
A.x=V/(11.2n) B.0<x≤0.5
C.V=33.6n(1-x) D.11.2n<V≤22.4n
难度: 中等查看答案及解析
-
合理利用燃料减小污染符合“绿色奥运”理念,下列关于燃料的说法正确的是( )
A.“可燃冰”是将水变为油的新型燃料
B.氢气是具有热值高、无污染等优点的燃料
C.乙醇是比汽油更环保、不可再生的燃料
D.石油和煤是工厂经常使用的可再生的化石燃料
难度: 简单查看答案及解析
-
下列有关铁元素的叙述中正确的是( )
A.氢氧化铁可以由相关物质通过化合反应而制得
B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI=FeI3+3H2O
D.铁元素位于周期表的第四周期 VIIIB族
难度: 中等查看答案及解析
-
一般来说,同一主族的元素最外层电子数相同,其单质及其对应的化合物具有相似的性质。下列关于同主族元素所形成的物质的性质推理中,正确的是
A.Li在氧气中燃烧生成 Li2O,故Na在氧气中燃烧也生成Na2O
B.Cl2能置换出NaBr溶液中的溴,故I2也能置换出NaBr溶液中的溴
C.Na与Cl2反应能形成离子键,故K与Cl2反应也能形成离子键
D.C在自然界有稳定的单质存在,故Si在自然界也有稳定的单质存在
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列对于0.3mol/L的硫酸钾溶液的说法中不正确的是
A.1L溶液中含有0.6NA个钾离子
B.1L溶液中含有钾离子和硫酸根离子总数为0.9NA
C.2L溶液中钾离子浓度为1.2mol/L
D.2L溶液中含有硫酸根离子0.6NA个
难度: 中等查看答案及解析
-
现有常温下pH均等于5的HCl溶液和NH4Cl溶液,下列说法正确的是
A.两溶液中n(H+)相等 B.两溶液中c(Cl-)相等
C.两溶液中c(OH-)相等 D.两溶液中水的电离程度相等
难度: 中等查看答案及解析
-
已知热化学反应方程式:2H2(g)+O2(g)=2H2O(g) ΔH1=-483.6 kJ/mol,则对于热化学方程式:2H2O(l)=2H2(g)+O2(g) ΔH2,下列说法正确的是( )
A.热化学方程式中化学计量数表示分子个数 B.该反应的ΔH2=+483.6 kJ/mol
C.ΔH2<ΔH1 D.ΔH2>ΔH1
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.苯酚沾在手上,应立即用NaOH溶液清洗
B.给试管中液体加热时,液体不超过试管容积的
C.用升华法分离碘和氯化铵的混合物
D.试管壁上的银镜可用稀硫酸洗涤
难度: 中等查看答案及解析
-
在某一澄清、透明的浅黄色溶液中,可能含有下列八种离子:H+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、I-,在检验方案设计时初步分析其溶液中最多可含离子(不包括OH-)( )
A.4种 B.5种 C.6种 D.7种
难度: 中等查看答案及解析
-
下列叙述中,错误的是( )
A.虽然固体氯化钠不能导电,但氯化钠是电解质
B.纯水的pH随温度的升高而减小
C.在醋酸钠溶液中加入少量氢氧化钠,溶液中c(OH-)增大
D.在纯水中加入少量硫酸铵,可抑制水的电离
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.在氨水中通入过量SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.在次氯酸钠溶液中通入少量SO2:2ClO-+H2O+SO2=2HClO+SO32-
C.在氢氧化钠溶液中通入一定量的CO2:3OH-+2CO2=CO32-+HCO3-+H2O
D.在硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O
难度: 中等查看答案及解析
-
工业上生产MnO2和Zn的主要反应有:
①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O
MnO2+Zn+2H2SO4 下列说法不正确的是( )
A.H2SO4氧化性大于MnO2 B.①中析出16 g S时转移l mol电子
C.②反应电解时阴极上Zn2+先放电 D.硫酸在该生产中可循环利用
难度: 中等查看答案及解析
-
铝可与硝酸钠发生反应:Al+NaNO3+H2O→Al(OH)3+N2↑+NaAlO2(未配平),有关叙述正确的是( )
A.该反应的氧化剂是水
B.若反应过程中转移5 mol e-,则生成标准状况下N2的体积为11.2 L
C.该反应的氧化产物是N2
D.当消耗1 mol Al时,生成标准状况下N2的体积为22.4 L
难度: 中等查看答案及解析
-
用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
A.20 mL 2 mol/L FeCl3溶液 B.40 mL 1 mol/L NaHCO3溶液
C.20 mL 1 mol/L Na2SO3溶液 D.40 mL 2 mol/L NH4HCO3溶液
难度: 简单查看答案及解析
-
向100 mL 0.25 mol·L-1的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是( )
A.3.45 g B.2.3 g C.1.15 g D.0.575 g
难度: 中等查看答案及解析
-
将一定体积的CO2通入V LNaOH溶液中,已知NaOH无剩余。若在反应后的溶液中加入足量澄清石灰水,得到ag沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到bg沉淀,则下列说法正确的是
A. 参加反应的CO2的体积为0.224aL
B. 用上述数据不能确定NaOH溶液的物质的量浓度
C. 若a=b,则CO2与NaOH溶液反应的产物盐只有Na2CO3
D. b可能等于a、小于a或大于a
难度: 困难查看答案及解析
-
如图是某溶液在稀释过程中,溶质的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析可得出a值等于:
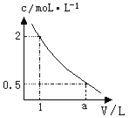
A.2 B.3 C.4 D.5
难度: 中等查看答案及解析
-
用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是

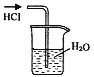
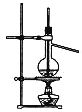
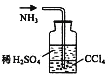
A.干燥Cl2 B.吸收HCl C.石油的分馏 D.吸收NH3
难度: 中等查看答案及解析