-
实验结束时,熄灭酒精灯的正确方法是( )
A. 用灯帽盖灭 B. 用水浇灭
C. 用嘴吹灭 D. 用干抹布盖灭
-
小明知道蛋壳的主要成分是碳酸钙,愚人节这天决定送妈妈一个“无壳鸡蛋”。他从厨房中取来一个鸡蛋及一杯物质,将蛋泡在其中,只见蛋的表面冒出大量气泡,两天后就得到一个没有壳的蛋。他应取下列哪一种物质( )
A. 醋 B. 高粱酒 C. 酱油 D. 食盐水
-
下列有关叙述正确的是( )
A. 电泳现象可证明胶体带电荷
B. 直径在1~100 nm之间的粒子称为胶体
C. 是否具有丁达尔效应是溶液和胶体的本质区别
D. 胶体粒子很小,可以透过滤纸
-
镁、铝合金粉末10.2g溶于500mL 4mol·L-1盐酸中恰好完全反应。若加入2mol·L-1的氢氧化钠溶液,使得沉淀达到最大量,则需加入氢氧化钠溶液的体积为
A.100mL B.500mL C.1000mL D.1500mL
-
下列化学方程式中,不能用离子方程式Ba2++SO42-=BaSO4↓表示的是( )
A.Ba(NO3)2 +H2SO4=BaSO4↓+2HNO3 B.BaCl2+Na2SO4=BaSO4↓+2NaCl
C.BaCO3+H2SO4=BaSO4↓+H2O+CO2↑ D.BaCl2+H2SO4=BaSO4↓+2HCl
-
用可溶性钡盐检验SO42-离子的存在时,先在待测溶液中加入盐酸,其作用是( )
A.形成较多的白色沉淀
B.形成的沉淀纯度更高
C.排除SO42-以外的其它阴离子及Ag+的干扰
D.排除Ba2+以外的其它阳离子的干扰
-
下列关于金属的叙述中正确的是( )
A.常温下所有的金属都是固态
B.金属具有导电、导热和延展性
C.金属都具有较高的硬度和密度
D.金属都具有较高的熔点和沸点
-
粘土胶体溶液中,粘土粒子带负电,为了使粘土粒子凝聚,下列物质中用量最少但最有效的电解质是( )
A.磷酸钠 B.硫酸铝 C.氯化钡 D.硫酸钾
-
不锈钢通常不与酸、碱、盐反应,是因为加入了( )
A.Ni和Cr B.Ni和Au
C.Cr和Au D.Cr和Pt
-
下列物质转化过程中硫元素化合价降低的是( )
A.H2SO4→SO2 B.H2S→SO2 C.S→SO2 D.SO2→SO3
-
只能用焰色反应才能鉴别的一组物质是( )
A. NaCl、CuCl2 B. NaCl、Na2CO3 C. Na2CO3、K2CO3 D. NH4Cl、Ba(NO3)2
-
下列各溶液中n(Na+)与100 mL 0.1 mol/L Na2SO4溶液中n(Na+)相同的是( )
A.100 mL 0.1 mol/L NaCl 溶液
B.50 mL 0.2 mol/L NaNO3溶液
C.100 mL 0.1 mol/L NaHSO4溶液
D.200mL 0.2mol/L HCl溶液与100 mL 0.2 mol/L NaHCO3溶液混合
-
在两个容积相同的容器中,一个盛有NH3气体,另一个盛有H2和O2的混合气体。在同温同压下,两容器内的气体不可能具有相同的
A.原子数 B.分子数 C.质量 D.电子数
-
下列关于硅酸盐材料的说法错误的是( )
A. 生活中常见的硅酸盐材料有玻璃、水泥、陶瓷
B. 普通玻璃的主要成分是二氧化硅
C. 陶瓷的主要原料是黏土
D. 硅酸盐水泥以石灰石和黏土为主要原料
-
足量下列物质与等质量的铝反应,放出氢气且消耗溶质物质的量最少的是( )
A. 氢氧化钠溶液 B. 稀硫酸 C. 盐酸 D. 氨水
-
下列关于硫的说法不正确的是( )
A.试管内壁附着的硫可用二硫化碳溶解除去
B.游离态的硫存在于火山喷口附近或地壳的岩层里
C.单质硫既有氧化性,又有还原性
D.硫在空气中的燃烧产物是二氧化硫,在过量纯氧中的燃烧产物是三氧化硫
-
经分析,某物质只含有一种元素,则该物质
A.一定是纯净物 B.可能是化合物
C.一定是混合物 D.可能是纯净物,也可能是混合物
-
用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于该实验现象的解释不正确的是( )
A.氧化铝与酸不反应 B.铝在空气中能很快形成氧化膜
C.氧化铝的熔点比铝高 D.铝箔表面未熔化
-
氮的固定是指( )
A.植物从土壤中吸收氮肥
B.大豆的根瘤菌将含氮的化合物转变为植物蛋白质
C.将空气中的氮气转变为氮的化合物
D.硝酸和氨气反应生成氮肥
-
安徽省庐江县有丰富的钒矿资源——明矾,有关明矾的说法正确的是( )
A. 明矾既可以除去水中的悬浮物,也可以杀菌消毒
B. 可以通过电解明矾溶液的方法来制取金属铝
C. 用酒精灯加热铝箔至熔化,铝并不滴落,说明氧化铝的熔点比铝高
D. 明矾溶液与某一溶液混合有白色沉淀生成,该溶液一定是碱溶液
-
下列对于“摩尔”的说法和理解正确的是( )
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔可以把物质的宏观数量与微观粒子的数量联系起来
C.国际上规定,0.012 kg碳原子所含有的碳原子数目为1 mol
D.摩尔是物质的量的单位,简称摩,符号为mol
-
下列关于胶体的叙述不正确的是( )
A.向氢氧化铁胶体中加入少量稀硫酸会产生红褐色沉淀
B.丁达尔效应并不是胶体特有的性质
C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象
-
下列物质属于铁合金的是( )
A.铁水 B.氧化铁 C.钢 D.赤铁矿
-
下列离子方程式的书写正确的是( )
A. H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH﹣+H++SO42—=BaSO4↓+H2O
B. 将Na投入到CuSO4溶液中:2Na+Cu2+=2Na++Cu↓
C. 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO﹣+CO2↑+H2O
D. 将Cl2通入水中:Cl2+H2O=2H++Cl﹣+ClO﹣
-
下列各溶液中,Na+物质的量浓度最大的是( )
A.4 L、0.5 mol·L-1NaCl溶液 B.1 L、0.3 mol·L-1Na2SO4溶液
C.5 L、0.4 mol·L-1NaOH溶液 D.2 L、0.15 mol·L-1、Na3PO4溶液
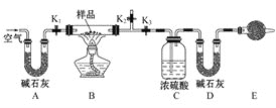
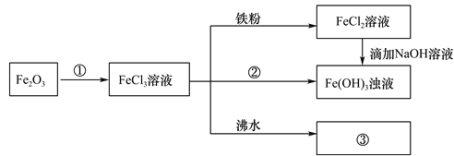
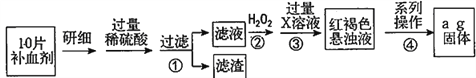
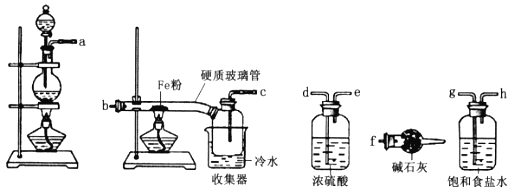


 b.
b.  d.
d. 