-
化学与生产、生活、环境等息息相关,下列说法中错误的是( )
A.港珠澳大桥采用的超高分子量聚乙烯纤维吊绳,是有机高分子化合物
B.“玉兔二号”月球车首次实现在月球背面着陆,其帆板太阳能电池的材料是硅
C.共享单车利用太阳能发电完成卫星定位,有利于节能环保
D.泡沫灭火器适用于一般的起火,也适用于电器起火
难度: 中等查看答案及解析
-
NA代表阿伏伽德罗常数,下列说法正确的是( )
A.标准状况下,560mL的氢气和氯气的混合气体充分反应后共价键数目为0.05NA
B.标准状况下,2.24LCl2通入NaOH溶液中反应转移的电子数为0.2NA
C.常温常压下,1.5molHCHO和C2H2O3的混合物完全充分燃烧,消耗的O2分子数目为1.5NA
D.0.1mol/L的NH4Cl溶液中通入适量氨气呈中性,此时溶液中NH4+数目为NA
难度: 中等查看答案及解析
-
螺环烃是指分子中两个碳环共用一个碳原子的脂环烃。
是其中的一种。下列关于该化合物的说法正确的是( )
A.与HBr以物质的量之比1:1加成生成二种产物
B.一氯代物有五种
C.所有碳原子均处于同一平面
D.该化合物的分子式为C10H12
难度: 中等查看答案及解析
-
已知:乙醇、乙醛的沸点分别为78℃、20.8℃。某同学试图利用下列实验装置来完成“乙醛的制备、收集和检验”一系列实验,其中设计不合理的是
A. 提供乙醇蒸气和氧气
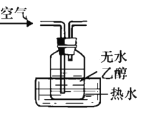
B. 乙醇的催化氧化

C. 收集产物
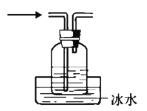
D. 检验乙醛

难度: 中等查看答案及解析
-
电解合成1,2-二氯乙烷的实验装置如图所示。下列说法中不正确的是( )
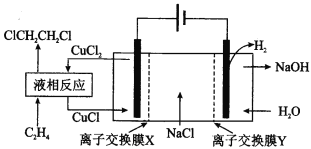
A.该装置工作时,阴极区溶液中的离子浓度不断增大
B.液相反应中,C2H4被CuCl2氧化为1,2-二氯乙烷
C.X、Y依次为阳离子交换膜、阴离子交换膜
D.该装置总反应为CH2=CH2+2H2O+2NaCl
H2↑+2NaOH+ClCH2CH2Cl
难度: 中等查看答案及解析
-
M、X、Y、Z、W为五种短周期元素,且原子序数依次增大,X、Y、Z最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L−1;W的质子数是X、Y、Z、M四种元素质子数之和的
。下列说法正确的是( )
A.原子半径:W>Z>Y>X>M
B.常见气态氢化物的稳定性:X<Y<Z
C.1molWM溶于足量水中完全反应,共转移2mol电子
D.由M、X、Y、Z四种元素形成的化合物一定既有离子键,又有共价键
难度: 中等查看答案及解析
-
常温时,1mol/L的HA和1mol/L的HB两种酸溶液,起始时的体积均为V0,分别向两溶液中加水进行稀释,所得变化关系如图所示(V表示溶液稀释后的体积)。下列说法错误的是
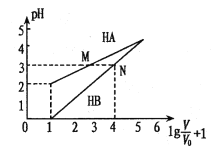
A.Ka( HA)约为10-4
B.当两溶液均稀释至
时,溶液中
>
C.中和等体积pH相同的两种酸所用n(NaOH):HA>HB
D.等体积、等物质的量浓度的NaA和NaB溶液中离子总数前者小于后者
难度: 中等查看答案及解析

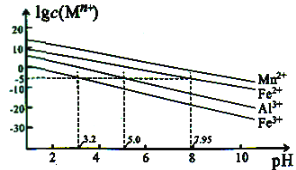

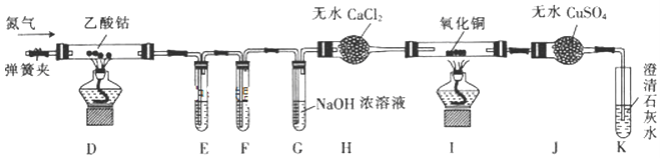
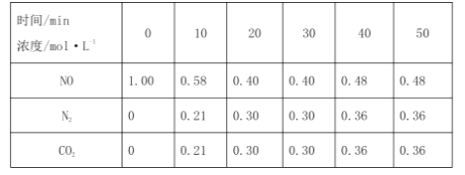

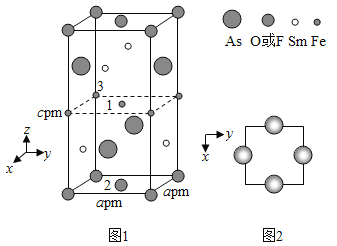
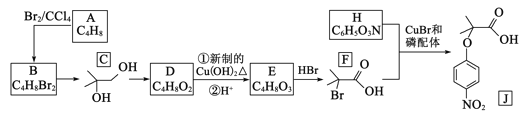
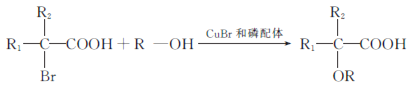
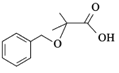 的合成路线:__________________。
的合成路线:__________________。