-
下列说法正确的是
A.盐溶液都是中性的
B.盐溶液的酸碱性与盐的类型无关
C.NaHCO3溶液显酸性
D.Na2CO3溶液显碱性,是因为溶液中c(OH-)>c(H+)
难度: 简单查看答案及解析
-
下列说法正确的是( )
①世博会中国馆——“东方之冠”使用的钢筋混凝土属于高分子化合物;
②CH3COONa,BaSO4都是强电解质;
③明矾和氯气可用于饮用水的净化和杀菌消毒,且两者的作用原理不同;
④0.1mol/L NaOH溶液与0.1mol/L Ba(OH)2溶液的pH相同;
⑤一定温度下,适量CO2分别通入饱和碳酸钠溶液和澄清石灰水中,都会出现浑浊。
A.①③④ B.①②④ C.②③⑤ D.③④⑤
难度: 简单查看答案及解析
-
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数
酸
HClO4
H2SO4
HCl
HNO3
Ka
1.6×10-5
6.3×10-9
1.6×10-9
4.2×10-10
从以上表格中判断下列说法正确的是( )
A.在冰醋酸中这四种酸都完全电离
B.在冰醋酸中高氯酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H+ +SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
难度: 中等查看答案及解析
-
鱼油的主要成分是EPA 和DHA,二者分别是二十碳五烯酸和二十二碳六烯酸,它们都是人体不可缺少的营养素,下列有关它们的说法不正确的是
①EPA和DHA含有相同的官能团,是同系物,化学性质相似
②1molEPA最多可与5molH2进行加成反应
③二者都既能使溴的四氯化碳溶液褪色,也能使酸性高锰酸钾溶液褪色
④二者均是高分子化合物.
A.②④ B.①④ C.①③ D.②③
难度: 中等查看答案及解析
-
下列关于苯酚的叙述中,错误的是( )
A.苯酚在水中的溶解度随温度的升高而增大
B.苯酚易溶于乙醇等有机溶剂
C.苯酚没有毒,其稀溶液可用作防腐剂和消毒剂
D.苯酚水溶液呈弱酸性,能与碱反应
难度: 简单查看答案及解析
-
大气污染物氟利昂—12的分子式是CF2Cl2,它是一种卤代烃,关于氟利昂—12的说法错误的是( )
A.它有两种同分异构体
B.化学性质虽稳定,但在紫外线照射下,可发生分解,产生的氯原子可引发损耗 O3的反应
C.大多数无色
D.它可看作甲烷分子的氢原子被氟、氯原子取代后的产物
难度: 简单查看答案及解析
-
已知:
①Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l) ΔH1
②2H2O(l)=2H2(g)+O2(g) ΔH2
③2H2O2(l)=2H2O(l)+O2(g) ΔH3
④Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH4
则ΔH4的正确表达式为( )
A.ΔH4=ΔH1+
×ΔH2+
×ΔH3 B.ΔH4=ΔH1+
×ΔH2—
×ΔH3
C.ΔH4=ΔH1+2×ΔH2—2×ΔH3 D.ΔH4=2×ΔH1+ΔH2+ΔH3
难度: 中等查看答案及解析
-
化学与生产、生活、社会密切相关,下列有关说法中不正确的是( )
A.绿色荧光蛋白质(GFP)是高分子化合物,不可降解,其水溶液有丁达尔效应
B.五彩缤纷的北京奥运会焰火利用了“焰色反应”原理
C.三聚氰胺分子结构如图所示
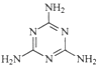 ,分子式是C3H6N6
,分子式是C3H6N6D.氮化硅、光导纤维、氧化铝陶瓷等属于新型无机非金属材料
难度: 中等查看答案及解析
-
某温度下,将浓度为0.01mol·L-1盐酸与0.0 1mol·L-1的NaOH溶液等体积混合,混合后水的电离程度与该温度下纯水的电离程度( )
A. 前者大 B. 后者大 C. 相等 D. 无法判断
难度: 中等查看答案及解析
-
在恒温条件下,欲使CH3COONa的稀溶液中
比值增大,可在溶液中加入少量下列物质中的( )
①固体NaOH ②固体KOH ③固体NaHSO4 ④固体CH3COONa ⑤冰醋酸
A.只有①② B.只有③⑤ C.只有②④⑤ D.只有①⑤
难度: 简单查看答案及解析
-
美国科学家罗伯特•莱夫科维茨和布莱恩•克比尔卡因“G 蛋白偶联受体研究”而获得2012年诺贝尔化学奖,他们将碘的同位素附着到各种激素上,借助放射学找到一些受体,进一步研究出“G 蛋白偶联受体”发挥的作用和机理,下列有关说法正确的是( )
A.放射性同位素
I 原子核内中子数与质子数的差为 78
B.蛋白质是生物体维持生命活动所需能量的主要来源
C.动物蛋白质和植物蛋白质混合摄入,更能增强蛋白质的营养作用
D.“春蚕到死丝方尽,蜡烛成灰泪始干”其中的“丝”和“泪”化学成分都是蛋白质
难度: 中等查看答案及解析
-
在100 mL某一元弱酸的溶液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示。

下列叙述正确的是( )
A.该弱酸在滴定前的浓度是0.15 mol/L
B.该弱酸稀释10倍后pH为4
C.滴定过程为求滴定终点,最合适的指示剂是酚酞
D.滴定过程为求滴定终点,最合适的指示剂是甲基橙
难度: 中等查看答案及解析
-
下列关于电离常数的说法正确的是( )
A.电离常数随着弱电解质的浓度增大而增大
B.CH3COOH的电离常数表达式为K=
C.CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小
D.电离常数只与温度有关,与浓度无关
难度: 中等查看答案及解析
-
已知热化学方程式:SO2(g)+1/2O2(g)
SO3(g) ΔH=-98.32 kJ·mol-1,在一定温度的密闭容器中充入2 mol SO2和1molO2充分反应,经过一段时间放出的热量为98.32 kJ,则容器中的压强与起始时压强的比值为( )
A. 3/2 B. 2/3 C. 6/5 D. 5/6
难度: 简单查看答案及解析
-
可逆反应A+B(s)
C达到平衡后,无论加压或降温,A的转化率都增大,则下列结论正确的
A. A为固体,C为气体,正反应为放热反应
B. A为气体,C为固体,正反应为吸热反应
C. A为气体,C为固体,正反应为放热反应
D. A、C均为气体,正反应为吸热反应
难度: 中等查看答案及解析
-
一定量的某饱和一元醛发生银镜反应,析出银21.6g,等量的此醛完全燃烧时,生成的水为5.4g,则该醛可能是( )
A.丙醛
B.乙醛
C.丁醛
D.甲醛
难度: 中等查看答案及解析
-
甲、乙两个烧瓶收集等量的NO2气体并密封,又知2NO2
N2O4ΔH<0,将甲置于热水中,乙置于冷水中。下列有关现象描述中正确的是( )
A.甲颜色加深 B.乙颜色加深
C.甲、乙颜色都加深 D.甲、乙颜色都变浅
难度: 简单查看答案及解析
-
合成氨所需的H2可由煤和水蒸气反应而制得,其中一步的反应为:CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH< 0,下列措施中,能提高CO转化率的是( )
A.增大压强 B.升高温度 C.增大水蒸气浓度 D.增大CO浓度
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.氯水能导电,所以氯气是电解质
B.碳酸钙不溶于水,所以它是非电解质
C.固体磷酸是电解质,所以磷酸在熔融状态下和溶于水时都能导电
D.胆矾虽不能导电,但它属于电解质
难度: 中等查看答案及解析
-
已知含Cr(Ⅵ)的盐溶液存在如下平衡:
(黄色)+2H+⇌
(橙色)+H2O,改变溶液中
、
的离子浓度比,可使溶液颜色发生变化。现向显黄色的试液中加入哪种物质,能使溶液变为橙色( )
A.H2O B.硫酸 C.NaOH(s) D.Na2SO4(s)
难度: 中等查看答案及解析
-
下列有关光合作用的说法不正确的是( )
A.将无机物转化为有机物 B.反应物的总能量高于生成物的总能量
C.将太阳能转变为化学能 D.是自然界碳元素循环的重要途径
难度: 中等查看答案及解析
-
欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是( )
A.Ag和AgCl溶液 B.Ag和AgNO3溶液
C.Pt和Ag2CO3溶液 D.Pt和Ag2SO4溶液
难度: 中等查看答案及解析
-
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
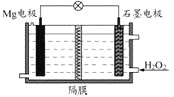
A.Mg 电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH 增大
D.溶液中Cl-向正极移动
难度: 中等查看答案及解析
-
把在空气中久置的铝片 5.0 g投入盛有500mL0.5mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率v与反应时间t可用如右的坐标曲线来表示,下列推论错误的是
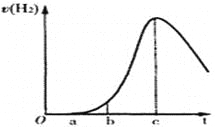
A.t由0→a段不产生氢气是因为表面的氧化物隔离了铝和硫酸溶液
B.t由b→c段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时反应处平衡状态
D.t>c产生氢气的速率降低主要是因为溶液中c(H+)降低
难度: 简单查看答案及解析
-
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-=Li2S+Fe。有关该电池的下列说法中正确的是( )
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为2Li+FeS=Li2S+Fe
C.负极的电极反应式为Al-3e-=Al3+
D.能用硫酸作为电解质溶液
难度: 中等查看答案及解析
-
在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g)
CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水蒸气质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A. ①②⑤ B. ③④⑥ C. ⑥⑦ D. ④⑤
难度: 简单查看答案及解析

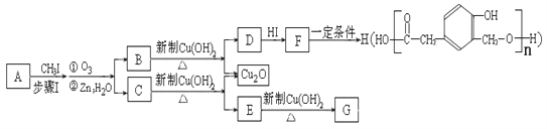
 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)