-
下列文字表述与对应的化学用语或名称关系正确的是
A.CS2的电子式为
B.光气(COCl2)结构式为
C.
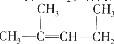 的名称为1,3-二甲基-2-丁烯
的名称为1,3-二甲基-2-丁烯D.NaH中氢离子结构示意图为
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数,下列说法正确的是
A.标准状况下,22.4LSO3中含有氧原子数目为3NA
B.在25℃、101kPa下,1 mol 硫和2 mol硫燃烧热相等
C.18 g D2O中含有的质子数目为10NA
D.含0.5 mol H2SO4的稀溶液与含0.5mol Ba(OH)2 的晶体完全中和所放出的热量为中和热
难度: 简单查看答案及解析
-
下列离子组可能大量共存的是
A.甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+
B.石蕊呈蓝色的溶液中:Na+、AlO2-、NO3-、NH4+
C.含大量Al3+的溶液中:K+、Na+、NO3-、HCO3-
D.含大量H+的溶液中:SO42-、Cl-、F-、K+
难度: 中等查看答案及解析
-
下列离子方程式中正确的是
A.在硫酸氢钾溶液中加入氢氧化钡溶液至pH =7:Ba2++OH—+H++SO42—=BaSO4↓+H2O
B.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
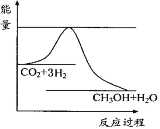
C.甲醇、氧气和氢氧化钾溶液组成的燃料电池的负极反应:CH3OH+H2O-6e—=CO2↑+6H+
D.NH4A1(SO4)2溶液中加入过量Ba(OH)2溶液:A13++2SO42—+2Ba2++4OH—=A1O2—+2BaSO4↓+2H2O
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.氮化镁投入过量盐酸 Mg3N2+6H+=3Mg2++2NH3↑
B.硫化亚铁固体投入过量稀硝酸 3FeS+8H++2NO3—=3Fe2++2NO↑+3S+4H2O
C.过量二氧化硫通入次氯酸钠溶液 SO2+ClO-+H2O=SO42-+Cl—+2H+
D.偏铝酸钠溶液中通入足量二氧化碳 2AlO2—+CO2+2H2O=2Al(OH)3↓+CO32—
难度: 中等查看答案及解析
-
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)= CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+
O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( ).
A.-488.3 kJ/mol B.-244.15 kJ/mol C.488.3 kJ/mol D.244.15 kJ/mol
难度: 中等查看答案及解析
-
A、B、C、D、E五种元素原子序数逐渐增大,且均不超过18。其中A与C、B与E分别为同族元素。原子半径A<B<E<D<C,B原子最外层电子数是次外层的3倍,C、D的核外电子数之和与B、E核外电子数之和相等。下列说法正确的是
A.原子电子层数:A<B B.气态氢化物的稳定性:B<E
C.简单离子半径:E<D D.最高价氧化物对应的水化物碱性:C<D
难度: 中等查看答案及解析
-
25℃时浓度都是1 mol/L的四种正盐溶液:AX、BX、AY、BY。AX的溶液pH=7且溶液中c(X-)=1mol/L,BX的溶液pH=4,BY的溶液pH=6。下列说法正确的是
A.电离平衡常数K(BOH)<K(HY)
B.AY溶液的pH值小于BY的pH值
C.稀释相同倍数,溶液pH值变化BX小于BY
D.AY溶液的pH值小于7
难度: 中等查看答案及解析
-
常温下,有关水溶液pH的下列说法中正确的是
A.在pH=12的溶液中,水电离出的c(OH-)=10-2mol·L-1
B.将pH=2和pH=12的酸、碱溶液等体积混合后,溶液的pH=7
C.若强酸、强碱中和后pH=7,则中和之前pH酸+pH碱=14
D.含等物质的量的HNO3、Na2CO3、CH3COOH的溶液混合后,溶液的pH>7
难度: 中等查看答案及解析
-
一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:
2X(g)+Y(g)
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A.以X浓度变化表示的反应速率为0.001mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
难度: 中等查看答案及解析
-
某温度下,H2(g)+CO2(g)
H2O(g)+CO2(g)的平衡常数
。该温度下在甲、乙、丙三个恒容密闭容器中,
起始浓度
甲
乙
丙
c(H2)/mol
L-1
0.010
0.020
0.020
c(CO2)/mol
L-1
0.010
0.010
0.020
投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是
A.
 的同分异构体中,有醇、酚、酯类物质
的同分异构体中,有醇、酚、酯类物质B.1 mol
 最多能与4 mol NaOH反应
最多能与4 mol NaOH反应C.纯净物C4H8的核磁共振氢谱峰最多为4
D.化学式为C8H8的有机物,一定能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
某温度下,相同pH的硫酸和硫酸铝溶液中由水电离出的c(H+)分别是1.0×l0-10 mol•L-1和1.0×10-3 mol•L-1,则此温度下水的离子积Kw为( )
A.1.0×l0-15 B.1.0×10-14 C.1.0×10-13 D.1.0×l0-7
难度: 中等查看答案及解析
-
在一密闭容器中充入X和Y,在一定条件下进行如下反应:aX(g)+bY(g)
cZ(g)+dW(s),如图I是不同温度下反应达到平衡时,反应混合物中Z的体积分数和压强关系的示意图,下列说法中正确的是
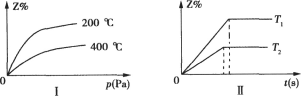
A.由图I得K(200℃)>K(400℃),但a+b与c+d的大小无法比较
B.若a=c,在保持Y浓度不变的前提下,使X和Z的浓度增大相同的倍数,平衡正向移动
C.若反应在恒容容器中进行,达平衡后再充入气体Z,由于压强增大,平衡正向移动
D.该反应在不同温度下(T2>T1),Z的体积分数与时间的关系图象可用图Ⅱ表示
难度: 困难查看答案及解析